题目内容
【题目】化合物A[KxFe(C2O4)y·zH2O,其中铁元素为+3价]是一种重要的光化学试剂。
(1)制备化合物A的实验流程如下:
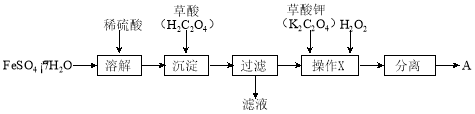
① 上述流程中,检验“过滤”后的固体已洗涤干净的方法是 。
② 上述流程“操作X”中加入H2O2的目的是 。
(2)测定化合物A的化学式实验步骤如下:
a、准确称取A样品4.91g,干燥脱水至恒重,残留物质的质量为4.37g;
b、将步骤a所得固体溶于水,加入还原铁粉0.28g,恰好完全反应;
c、另取A样品4.91g置于锥形瓶中,加入足量的3 mol/L的H2SO4溶液和适量蒸馏水,再加入0.50mol/L的KMnO4溶液24.0 mL,微热,恰好完全反应:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
通过计算填空,请写出解题过程。
① 4.91g A样品中含结晶水的物质的量为 mol。
② A样品中![]() = 。
= 。
③ A的化学式为 。
【答案】(1)① 取少量最后一次洗涤液于试管中,滴加BaCl2溶液,无白色沉淀,说明已洗涤干净。(2分)② 把Fe2+全部氧化成Fe3+
(2)①0.03(2分)②1:3(2分)③K3Fe(C2O4)3·3H2O(4分)
计算过程:n(H2O)=![]()
n(Fe3+)=2n(Fe)=![]()
n(C2O42-)=![]() n(KMnO4)=
n(KMnO4)=![]() ×0.50molL-1×0.024L=0.03mol
×0.50molL-1×0.024L=0.03mol
![]() =1:3
=1:3
根据离子电荷守恒:n(K+)+3n(Fe3+)=2n (C2O42-)得n(K+)=0.03mol
因此A为 K3Fe(C2O4)3·3H2O
【解析】
试题分析:(1)① 滤液中含有硫酸根,因此可以通过检验洗涤液中是否含有硫酸根判断是否洗涤干净。即取少量最后一次洗涤液于试管中,滴加BaCl2溶液,无白色沉淀,说明已洗涤干净。
②由于铁元素最终必需转化为铁离子,所以双氧水的作用是把Fe2+全部氧化成Fe3+。
(2)①样品中结晶水的物质的量n(H2O)=![]() ;
;
②n(Fe3+)=2n(Fe)=![]()
根据反应的方程式可知n(C2O42-)=![]() n(KMnO4)=
n(KMnO4)=![]() ×0.50molL-1×0.024L=0.03mol
×0.50molL-1×0.024L=0.03mol
所以![]() =1:3
=1:3
③根据离子电荷守恒n(K+)+3n(Fe3+)=2n (C2O42-)可得n(K+)=0.03mol
因此A为 K3Fe(C2O4)3·3H2O