题目内容
| A、导电性很强的物质 | B、在水溶液里或熔融状态下能导电的化合物 | C、可溶性盐类 | D、在水溶液里和熔融状态下能导电的化合物 |
B、电解质必须满足在水溶液里或熔融状态下能导电的化合物,故B正确;
C、电解质与溶解度没有必然关系,有的电解质不溶于水,如硫酸钡、碳酸钙等,它们都属于电解质,且为强电解质,故C错误;
D、电解质在水溶液中能够导电,但是在熔融状态下不一定能够导电,如共价化合物-氯化氢、硫酸,它们属于电解质,单在熔融状态下不导电,故D错误;
关系B.

(Ⅰ)(6分)现有下列物质: ①NaCl晶体 ②液态SO2 ③纯醋酸 ④硫酸钡 ⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液
请用以上物质回答下列问题。(填序号)
(1)在上述状态下能导电的物质是 ;
(2)属于弱电解质的是 ;
(3)属于非电解质,但溶于水后的水溶液能导电的是 ;
(Ⅱ)(4分)
某化学实验小组探究市售食用白醋中醋酸的的准确浓度,取25.00mL某品牌食用白
醋于锥形瓶中,在实验室用浓度为cb mol/L的标准NaOH溶液对其进行滴定。
(1)左图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,
A处的刻度为25,滴定管中液面读数应为 mL。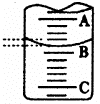
(2)为了减小实验误差,该同学一共进行了三次实验,假设每次
所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实
验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
其原因可能是 。
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
C.第一次滴定用的锥形瓶未润洗
D.滴定结束时,俯视读数
(3)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):
c= 。
(Ⅲ)(15分)
已知:在25时H2O
 H++OH- KW=10-14 CH3COOH
H++OH- KW=10-14 CH3COOH  H++ CH3COO- Ka=1.8×10-5
H++ CH3COO- Ka=1.8×10-5(1)取适量醋酸溶液,加入少量醋酸钠固体,此时溶液中C(H+)与C(CH3COOH)
的比值 (填“增大”或“减小”或“不变”)
(2)醋酸钠水解的离子方程式为 。当升高温度时,C(OH—)将
(填“增大”“减小”“不变”);
(3)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠
的比值)为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系
为 ,a与b的关系为 (填“大于”“小于”“等于”);
(4)将等体积等浓度的醋酸和氢氧化钠溶液混合后,所得溶液中离子浓度由大到小的顺序是 。
(5)若醋酸和氢氧化钠溶液混合后pH<7,则c(Na+)_______________ c(CH3COO-)(填“大于”、“小于”或“等于”),
(6)若由pH=3的HA溶液V1mL与pH=11的NaOH{溶液V2 mL。混合而得,则下列说法不正确的是____________。
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(7)在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol·L-1。向其中加入固
体醋酸钠后测得溶液的C(OH-)为2.2×10-5mol·L-1,以上三种金属离子中
能生成沉淀,原因是
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14)
(8)取10mL0.5mol·L-1盐酸溶液,加水稀释到500mL,则该溶液中由水电离出的c(H+)
= 。
题目:化学电池在通讯、交通及日常生活中有着广泛的应用。
前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O ![]() 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
(1)已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,放电就是使用电池的过程,充电是给电池补充电量的过程。以下说法中正确的是
① 以上反应不属于置换反应 ② 以上反应是复分解反应
③ 充电时化学能转变为电能 ④ 放电时化学能转变为电能
A.①③ B.②④ C.①④ D.②③
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍锡电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为
(3)另一种常用的电池是锂电池(它是一种碱金属元素,其相对原子质量为7,由于它的比容量(单位质量电板材料所能转换的电量)特别大而广泛应用于心脏起搏器,一般使用的时间可长达十年。它的负极用金属锂制成;电池总反应可表示为:Li+MnO2→LiMnO2试回答:锂电池比容量特别大的原因是
锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因
(4)下图是废弃镍钢电池中的重金属渗入水体后,进入人体的一条途径:
生物体D中重金属浓度 (大于、等于、小于)生物体A中重金属浓度,这是通过食物链 作用所引起的。除上述途径外,被污染水体中的重金属还可以直接通过 (途径)_________进入人体。
(5)下图是两个电池外壳上的说明文字某型号进口电池
某型号进口电池 | 某型号国产电池 |
| GNY 0.6(KR-AA) |
上述进口电池的电动势是 伏。上述国产电池最多可放出 毫安时的电量;若该电池平均工作电流为0.03安,则最多可使用 小时。
 RECHARGEABLE
RECHARGEABLE