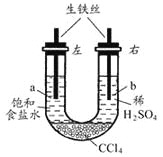
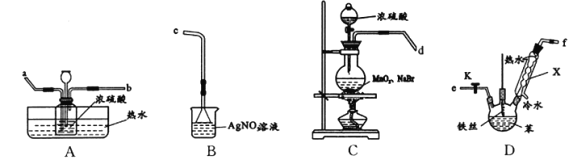
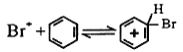
题目内容
【题目】常温下,将pH=10的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述中不正确的是( )
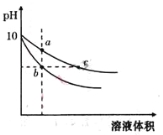
A.a、b两点溶液的导电能力不相同
B.a、b、c三点溶液中水的电离程度a>c>b
C.c点溶液中c(H+)+c(CH3COOH)=c(OH-)
D.若向上述两种溶液中分别加入相同浓度的盐酸至pH=7,则消耗盐酸体积相同
【答案】D
【解析】
试题分析:A.溶液的导电能力与离子浓度成正比,体积相等的醋酸钠和氢氧化钠,c(CH3COONa)>c(NaOH),所以a点导电能力大于b,即a、b两点溶液的导电能力不相同,故A正确;B.氢氧化钠对水的电离起抑制作用,而醋酸根离子浓度越大对水的电离程度越促进,所以a、b、c三点溶液中水的电离程度a>c>b,故B正确;C.任何电解质溶液中都存在质子守恒,根据质子守恒得C(H+)+C(CH3COOH)=C(OH-),故C正确;D.若向上述两种溶液中分别加入相同浓度的盐酸至pH=7,则消耗盐酸体积不可能相同,故D错误;故选D。

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目