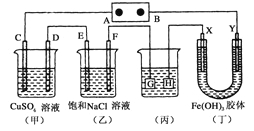
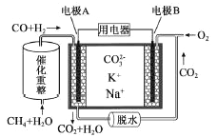
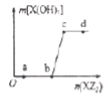
题目内容
【题目】将钠、镁、铝0.3mol分别放入100 mL 1mol.L-1 的盐酸中,在同温、同压下产生的气体体积比是
A.3:1:1 B.6:3:2 C.1:2:3 D.1:1:1
【答案】A
【解析】
试题分析:钠和盐酸、水都反应,镁和铝分别与盐酸反应方程式为Mg+2HCl=MgCl2+H2↑、2Al+6 HCl =2AlCl 3+3H2↑,0.3molMg、Al完全反应需要盐酸的物质的量分别是0.6mol、0.9mol,实际上n(HCl)=1mol/L×0.1L=0.1mol,所以镁和铝都剩余。盐酸完全反应,放出的氢气为0.05mol,根据2Na~H2↑可知,0.3molNa完全反应,生成氢气的物质的量=0.3mol×![]() =0.15mol,所以同温同压下产生的气体的物质的量之比=0.15mol:0.05mol:0.05mol=3:1:1,故选A。
=0.15mol,所以同温同压下产生的气体的物质的量之比=0.15mol:0.05mol:0.05mol=3:1:1,故选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目