题目内容
关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液。下列说法不正确的是( )
| A.c(NH4+);③>① |
| B.水电离出的c(H+):②>① |
| C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O) |
| D.①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
B
解析试题分析:A. ①氨水NH3·H2O NH4++ OH-。③氯化铵NH4Cl= NH+Cl-。氯化铵是强电解质,完全电离;NH3·H2O是若电解质,部分电离。因此当二者浓度相等时c(NH4+);③>①。正确。B.在任何物质的稀溶液中存在水电离平衡:H2O
NH4++ OH-。③氯化铵NH4Cl= NH+Cl-。氯化铵是强电解质,完全电离;NH3·H2O是若电解质,部分电离。因此当二者浓度相等时c(NH4+);③>①。正确。B.在任何物质的稀溶液中存在水电离平衡:H2O H++ OH-。当向水中加入HCl时,HCl电离产生的H+使c(H+)增大,对水的电离平衡起到了抑制作用;当向水中加入氨水时NH3·H2O电离产生的OH-会使溶液中的c(OH-)增大,抑制了水的电离。使水的电离程度减小。由于NH3·H2O是弱电解质,电离产生的离子浓度小于HCl电离产生的离子的浓度,因此对水的抑制HCl的强于氨水的。故水电离出的c(H+):①>②。错误。C.①和②等体积混合后的溶液:恰好发生反应得到NH4Cl。由于是强酸弱碱盐,弱酸根离子水解消耗水电离产生的OH-。使溶液显酸性。根据质子守恒可得:c(H+)=c(OH-)+c(NH3·H2O)。正确。D.①和③等体积混合后的溶液:得到的为NH3·H2O和NH4Cl的混合溶液。由于NH3·H2O的电离作用大于NH4+的水解作用。所以c(OH-)>c(H+);NH4Cl是强电解质,其电离作用大于弱电解质NH3·H2O的电离作用。所以c(Cl-)>c(OH-)。由于NH4+是由两种电解质电离电离产生,而Cl-只是一种电解质电离产生的。所以c(NH4+)>c(Cl-)。因此溶液中离子的浓度关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+)。正确。
H++ OH-。当向水中加入HCl时,HCl电离产生的H+使c(H+)增大,对水的电离平衡起到了抑制作用;当向水中加入氨水时NH3·H2O电离产生的OH-会使溶液中的c(OH-)增大,抑制了水的电离。使水的电离程度减小。由于NH3·H2O是弱电解质,电离产生的离子浓度小于HCl电离产生的离子的浓度,因此对水的抑制HCl的强于氨水的。故水电离出的c(H+):①>②。错误。C.①和②等体积混合后的溶液:恰好发生反应得到NH4Cl。由于是强酸弱碱盐,弱酸根离子水解消耗水电离产生的OH-。使溶液显酸性。根据质子守恒可得:c(H+)=c(OH-)+c(NH3·H2O)。正确。D.①和③等体积混合后的溶液:得到的为NH3·H2O和NH4Cl的混合溶液。由于NH3·H2O的电离作用大于NH4+的水解作用。所以c(OH-)>c(H+);NH4Cl是强电解质,其电离作用大于弱电解质NH3·H2O的电离作用。所以c(Cl-)>c(OH-)。由于NH4+是由两种电解质电离电离产生,而Cl-只是一种电解质电离产生的。所以c(NH4+)>c(Cl-)。因此溶液中离子的浓度关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+)。正确。
考点:考查电解质溶液中离子浓度大小的关系的知识。

将0.1 mol/L的NH3·H2O溶液加水稀释,下列说法正确的是( )
| A.c(NH)/c(NH3·H2O)比值减小 | B.OH-个数将减少 |
| C.c(OH-)/c(NH3·H2O)比值减小 | D.NH4+浓度将减小 |
在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:Ca(OH)2(s) Ca(OH)2(aq)
Ca(OH)2(aq) Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是( )
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是( )
| A.n(Ca2+)增大 | B.c(Ca2+)不变 | C.n(OH-)增大 | D.c(OH-)减小 |
下列有关电解质溶液的说法正确的是
| A.在蒸馏水中滴加浓H2SO4,Kw不变 |
B.CH3COOH溶液加水稀释后,溶液中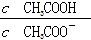 的值减小 的值减小 |
C.Na2CO3溶液中加入少量Ca(OH)2固体, 水解程度减小,溶液的pH减小 水解程度减小,溶液的pH减小 |
| D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
下列关于溶液的酸碱性,说法正确的是( )
| A.pH=7的溶液是中性 |
| B.中性溶液中一定:c(H+)=1.0×10-7 mol·L-1 |
| C.c(H+)=c(OH-)的溶液呈中性 |
| D.在100°C时,纯水的pH<7,因此显酸性 |
已知,常温下,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17,下列叙述中,正确的是( )
| A.常温下,AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 |
| B.向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色 |
| C.将0.001 mol·L-1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀 |
| D.向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-) |
两人用同一瓶标准盐酸滴定同一瓶NaOH溶液,甲将锥形瓶用NaOH待测液润洗后,使用水洗过的碱式滴定管取碱液于锥形瓶中,乙则用甲用过的碱式滴定管另取碱液于刚用水洗过且留有蒸馏水珠的锥形瓶中,其他操作及读数全部正确。下列说法正确的是( )
| A.甲操作正确 | B.乙操作有误 |
| C.甲测定的数值一定比乙小 | D.乙实际测得值较准确 |
下列说法正确的是( )
| A.难溶电解质作比较时,Ksp小的,溶解度一定小 |
| B.Ksp大小取决于难溶电解质的量,所以离子浓度改变时,沉淀溶解平衡会发生移动 |
| C.所谓沉淀完全就是用沉淀剂将溶液中某一离子完全除去 |
| D.温度一定,当溶液中Ag+和Cl-浓度的乘积等于Ksp时,溶液为AgCl的饱和溶液 |

 H+ + A2-
H+ + A2-