题目内容
15.下列说法正确的是( )| A. | 在含有3.6amolHNO3的稀溶液中,加入amolFe粉,反应的离子方程式为5 Fe+4NO3-+16H+=4NO+2Fe3++8H2O+3Fe2+ | |
| B. | 碳酸钠溶液中通入氯气,得到三种钠盐,则反应的离子方程式为Cl2+H2O+2CO32-=ClO-+Cl-+2HCO3- | |
| C. |  分子中所有原子共平面 分子中所有原子共平面 | |
| D. | 肌醇  与葡萄糖的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,二者均属于糖类化合物 与葡萄糖的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,二者均属于糖类化合物 |
分析 A.硝酸与Fe的物质的量比为3.6:1,介于8:3与4:1之间,生成铁离子、亚铁离子、NO和水;
B.可以看作氯气与水反应生成氯化氢和次氯酸,然后次氯酸和分别与碳酸钠反应生成碳酸氢钠、氯化钠、次氯酸钠;
C.该有机物分子中含有1个甲基,甲基中各原子不可能共平面;
D.据结构式书写化学式,环上没有标注元素符合的交点为碳原子,肌醇属于醇,不属于糖类.
解答 解:A.在含有3.6amolHNO3的稀溶液中,加入amolFe粉,硝酸与Fe的物质的量比为3.6:1,介于8:3与4:1之间,生成铁离子、亚铁离子、NO和水,amol铁与稀硝酸反应完全生成硝酸亚铁时,根据反应3Fe+8H++2NO3-═3Fe2++4H2O+2NO↑可知,amol铁完全反应消耗$\frac{8}{3}$amol硝酸,硝酸还剩余的物质的量为:3.6amol-$\frac{8}{3}$amol=$\frac{14}{15}$amol,剩余的硝酸发生反应:4H++NO3-+3Fe2+=3Fe3++2H2O+NO↑,其中被氧化生成铁离子的物质的量为:$\frac{14}{15}$mol×$\frac{3}{4}$=0.7amol,所以反应生成铁离子为0.7amol,生成亚铁离子为:amol-0.7amol=0.3amol,则正确的离子方程式为:10Fe+9NO3-+36H+=9NO+7Fe3++18H2O+3Fe2+,故A错误;
B.碳酸钠溶液中通入氯气,氯气与水反应生成次氯酸和氯化氢,次氯酸与碳酸钠反应生成次氯酸钠、碳酸氢钠,氯化氢与碳酸钠反应生成氯化钠、碳酸氢钠(或二氧化碳和水),若氯气少量,则反应的离子方程式为:Cl2+H2O+2CO32-=ClO-+Cl-+2HCO3-,故B正确;
C.苯环左侧为甲基,甲基为四面体结构,甲基中的三个H与苯环不可能全部共平面,故C错误;
D.二者化学式均为C6H12O6,满足Cm(H2O)n,但是肌醇分子中只含有羟基,属于醇,不属于糖类,故D错误;
故选B.
点评 本题考查离子方程式书写判断、有机物结构判断,题目浓度较大,注意掌握离子方程式书写原则,明确据此有机物结构特点,A为易错点,需要正确判断反应产物的量.

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案| A. | 容器内压强不随时间变化 | B. | V正(X)=2V逆(Z) | ||
| C. | 容器内X、Y、Z的浓度相等 | D. | 容器内气体密度不变 |
| A. | 二氧化硅溶于水显酸性 | |
| B. | 光导纤维传导光的能力非常强,利用光缆通讯,能同时传送大量信息 | |
| C. | 因为高温时二氧化硅与碳酸钠反应放出CO2,所以硅酸的酸性比碳酸强 | |
| D. | 作为宇航用的复合材料中,常用作基体的金属是镁、铝钛等黑色金属 |
| A. | 铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 | |
| B. | 常用的二次电池铅蓄电池充电时电池正极与电源负极相接 | |
| C. | 用铂电极电解CuSO4溶液,当Cu2+浓度降低至原来一半时,加入CuO使溶液恢复到原来浓度和质量 | |
| D. | 在轮船船壳吃水线下焊上铜块可避免船体遭受腐蚀 |
| A. | 用滴定管取所用药品 | |
| B. | NaOH溶液在倒入小烧杯时,有少量溅出 | |
| C. | 大小烧杯体积相差较大,夹层间放的碎泡沫塑料较多 | |
| D. | 测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度 |
| A. | Cu | B. | Cu(OH)2 | C. | H2 | D. | Na2SO4 |
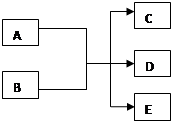 在一定条件下,某些化学反应可以如图框架表示(未注明反应条件),根据要求回答下列问题:
在一定条件下,某些化学反应可以如图框架表示(未注明反应条件),根据要求回答下列问题:


 .
. 或
或 (任写一种).
(任写一种). .
.