题目内容
现代工业将煤炭气化后,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以制成许多清洁能源、扩大水煤气的广泛用途。
(1)已知:①2C(s)+O2(g)=2CO(g) △H1=-221.0kJ.mol-1;
②2H2(g)+O2(g)=2H2O(g)△H2=-483.6kJ.mol-1
则反应C(s)+ H2O(g)= CO(g) + H2(g);△H=____ 。
(2)工业上有一种用CO2 来生产甲醇燃料的方法: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
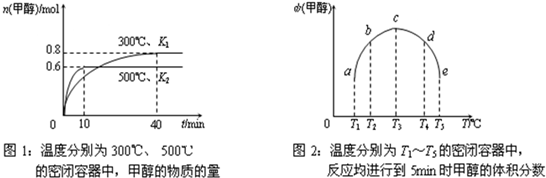
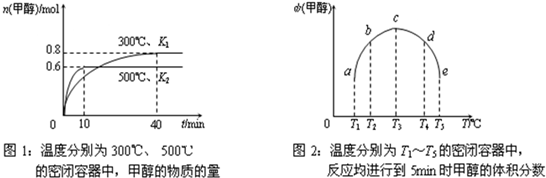
 现将6.0molCO2和8.0molH2充入2L的密闭容器中,测得H2的物质的量(n)随时间变化如下图所示(实线)。
现将6.0molCO2和8.0molH2充入2L的密闭容器中,测得H2的物质的量(n)随时间变化如下图所示(实线)。
①下列时间段平均反应速率最大的是______(填序号),
A.0~1min B.1~3min
C.3~8min D.8~11min
其速率是:υ(H2)=_________ 。
② 平衡时氢气的转化率 ;该条件下
反应的平衡常数K= 。
③仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是___________,曲线II对应的实验条件改变是_____________。
(3)某研究所组装的CH3OH—O2燃料电池的
工作原理如图所示。

①该电池工作时,b口通入的物质为 ,
②该电池正极的电极反应式为: 。
 ③以此电池做电源,在实验室中模拟铝制品表面
③以此电池做电源,在实验室中模拟铝制品表面
“钝化”处理(装置右图所示)的过程中,发现溶液
逐渐变浑浊并有气泡产生,其原因可能是
(用相关的离子方程式表示):
。
(1)+131.3kJ.mol-1(2分)
(2)①A ; 1.0 mol/L.min (2分)
② 75% (2分) ;0.5(L/mol)2 (2分)
③升高温度 ;增大压强
(3)①CH3OH
②O2+4e-+4H+=2H2O (2分)
③Al3++3HCO3-=Al(OH)3↓+3CO2↑ (2分)

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案