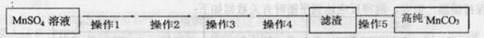题目内容
(14分)二氧化钛广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:TiCl4水解生成TiO2·xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2,此方法制备得到的是纳米二氧化钛。
(1)①TiCl4水解生成TiO2·xH2O的化学方程式为 。
②检验TiO2·xH2O中Cl-是否被除净的方法是 。
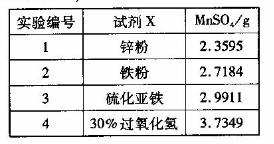
方法2:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下:

(2)Fe2O3与H2SO4反应的离子方程式是 。
(3)甲溶液中除含TiO2+之外还含有的金属阳离子有 。
(4)加Fe的作用是 。
Ⅱ、二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及到的步骤如下:
TiO2 TiCl4
TiCl4 Ti
Ti
反应②的方程式是 ,该反应需要在Ar气氛中进
行,请解释原因: 。
(14分,每空2分)
(1)①TiCl4 + (x + 2)H2O(过量) TiO2·xH2O↓ + 4HCl(写=不扣分)
TiO2·xH2O↓ + 4HCl(写=不扣分)
②取少量水洗液,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl-已洗净。
(2)Fe2O3 + 6H+ = 2Fe3+ + 3H2O
(3)Fe3+、Fe2+
(4)将Fe3+转化为Fe2+
(5)TiCl4 + 2Mg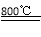 2MgCl2 + Ti;防止高温下Mg(Ti)与空气中O2(或CO2、N2)作用。
2MgCl2 + Ti;防止高温下Mg(Ti)与空气中O2(或CO2、N2)作用。
【解析】
试题分析:(1)①TiCl4水解生成TiO2·xH2O和氯化氢,根据元素守恒规律书写其化学方程式为
TiCl4 + (x + 2)H2O(过量) TiO2·xH2O↓ + 4HCl;
TiO2·xH2O↓ + 4HCl;
②检验沉淀是否被洗干净的方法是取少量洗涤后的溶液,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl-已洗净。
(2)Fe2O3与H2SO4发生反应生成硫酸铁和水,氧化铁是氧化物,不能拆开,硫酸是强酸,写成离子形式,所以离子方程式为Fe2O3 + 6H+ = 2Fe3+ + 3H2O ;
(3)FeTiO3中Ti元素化合价为+4价,则Fe为+2价,钛铁矿中含有氧化铁,所以甲溶液中除iO2+之外还含有的金属阳离子有Fe3+、Fe2+
(4)加Fe的作用是将Fe3+转化为Fe2+,便于Fe2+结晶为FeSO4·7H2O
(5)TiCl4与Mg在800℃发生置换反应生成钛和氯化镁,化学方程式为TiCl4 + 2Mg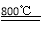 2MgCl2 + Ti;
2MgCl2 + Ti;
Mg与Ti在高温条件下易与空气中的氧气、二氧化碳发生反应,所以为了防止高温下Mg(Ti)与空气中O2(或CO2、N2)作用,该反应需要在Ar气氛中进行。
考点:考查工业制备钛、二氧化钛的反应原理,对工业流程的分析,化学方程式的书写

(15分)硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。

Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。请填写表中的空白:
棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
a |
| 棉球变白,微热后又恢复红色 |
|
b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
c |
| 棉球变为白色 | 该气体具有 (选填“氧化性”或“还原性”) |
Ⅱ、硬质玻璃管与其它装置结合完成定性或定量实验。下图是某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究的装置。

实验一:铁矿石中含氧量的测定
(1)按上图组装仪器(夹持仪器均省略),检查装置的气密性;
(2)将10.0g铁矿石放入硬质玻璃管中;
(3)从左端导气管口处不断地缓缓通入H2, 后,点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(5)测得反应后装置B增重2.70g,则铁矿石中氧的质量分数为______________________。
实验二:铁矿石中含铁量的测定

(1)步骤②和⑤中都要用到的玻璃仪器是 __。
(2)下列有关步骤⑥的操作中说法不正确的是_______。
A.滴定管用蒸馏水洗涤后再用待装液润洗
B.锥形瓶需要用待测液润洗
C.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成,由实验一、二得出该铁矿石中铁的氧化物的化学式为