题目内容
下列计算结果正确是( )
分析:A、令烧瓶的容积为VL,则氨气的体积为VL,根据n=
计算氨气的物质的量,再根据c=
计算溶液的物质的量浓度;
B、发生反应Cu+2H2SO4
CuSO4+SO2↑+2H2O,64g铜的物质的量为1mol,硫酸的物质的量为0.1L×18mol/L=0.18mol,由方程式可知,硫酸不足量,且随反应进行浓硫酸变为稀硫酸,铜与稀硫酸不反应,实际反应的铜小于1mol;
C、向1mol的碳酸钾固体中缓缓滴加少量的稀盐酸,首先反应生成碳酸氢钾,碳酸钾反应完毕,盐酸在于碳酸氢钾反应生成二氧化碳;
D、1mol Ba(OH)2溶液中通入1molCO2气体,前后反应生成1mol BaCO3白色沉淀.
| V |
| Vm |
| n |
| V |
B、发生反应Cu+2H2SO4
| ||
C、向1mol的碳酸钾固体中缓缓滴加少量的稀盐酸,首先反应生成碳酸氢钾,碳酸钾反应完毕,盐酸在于碳酸氢钾反应生成二氧化碳;
D、1mol Ba(OH)2溶液中通入1molCO2气体,前后反应生成1mol BaCO3白色沉淀.
解答:解:A、令烧瓶的容积为VL,则氨气的体积为VL,氨气的物质的量为
=
mol,氨水溶液的物质的量浓度为
=
mol/L,故A正确;
B、发生反应Cu+2H2SO4
CuSO4+SO2↑+2H2O,64g铜的物质的量为1mol,硫酸的物质的量为0.1L×18mol/L=0.18mol,由方程式可知,硫酸不足量,且随反应进行浓硫酸变为稀硫酸,铜与稀硫酸不反应,故1mol铜不能完全反应,生成的SO2气体小于1mol,体积小于22.4L,故B错误;
C、向1mol的碳酸钾固体中缓缓滴加少量的稀盐酸,首先反应生成碳酸氢钾,碳酸钾反应完毕,盐酸在于碳酸氢钾反应生成二氧化碳,是否生成二氧化碳及二氧化碳体积多少,与盐酸的量有关,故C错误;
D、1mol Ba(OH)2溶液中通入1molCO2气体,前后反应生成1mol BaCO3白色沉淀,故D错误;
故选A.
| VL |
| 22.4L/mol |
| V |
| 22.4 |
| ||
| VL |
| 1 |
| 22.4 |
B、发生反应Cu+2H2SO4
| ||
C、向1mol的碳酸钾固体中缓缓滴加少量的稀盐酸,首先反应生成碳酸氢钾,碳酸钾反应完毕,盐酸在于碳酸氢钾反应生成二氧化碳,是否生成二氧化碳及二氧化碳体积多少,与盐酸的量有关,故C错误;
D、1mol Ba(OH)2溶液中通入1molCO2气体,前后反应生成1mol BaCO3白色沉淀,故D错误;
故选A.
点评:本题考查物质的性质、化学计算等,难度中等,注意C选项中是否生成二氧化碳与盐酸的量有关.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
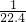 )mol/L
)mol/L )mol/L
)mol/L