题目内容
用石墨作电极电解2 mol·L-1的NaCl和1 mol·L-1的MgSO4混合溶液时,下列曲线合理的是 ( )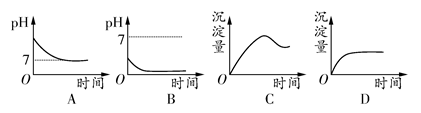
D
解析

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
原电池与电解池在生活和生产中有着广泛应用。下列有关判断中错误的是
装置① 装置② 装置③
| A.装置①研究的是电解CuCl2溶液,b电极上有红色固体析出 |
| B.装置②研究的是金属的吸氧腐蚀,Fe上的反应为Fe-2e- = Fe2+ |
| C.装置③研究的是电解饱和食盐水, B电极发生的反应:2Cl--2e- = Cl2↑ |
| D.三个装置中涉及的主要反应都是氧化还原反应 |
用电解法提取氯化铜废液中的铜,方案正确的是( )
| A.用铜片连接电源的正极,另一电极用铂片 |
| B.用碳棒连接电源的正极,另一电极用铜片 |
| C.用氢氧化铜溶液吸收阴极产物 |
| D.用带火星的木条检验阳极产物 |
将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )。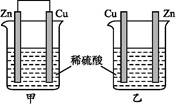
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的酸性均减弱 |
| D.产生气泡的速率甲比乙慢 |
科学家从电解冶炼铝的工艺中得到启发,找出了冶炼钛的新工艺——TiO2直接电解法生产钛,电解质为熔融的氯化钙,原理如图所示。下列说法错误的是 ( )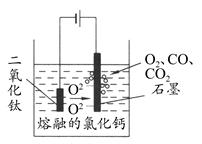
| A.阴极得到钛,电极反应式为TiO2+4e-=Ti+2O2- |
| B.阳极的电极反应式是2O2--4e-=O2↑,生成的部分氧气会将石墨氧化成CO和CO2 |
| C.在工业生产过程中应该不断地更换两极材料 |
| D.该法生产Ti符合绿色环保的要求 |
实验发现,298 K时,在FeCl3酸性溶液中加入少量锌粒后,Fe3+立即被还原成Fe2+。某化学兴趣小组根据该实验事实设计了如图所示的原电池装置。下列有关说法中正确的是 ( )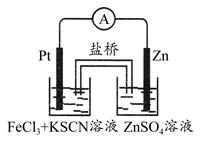
| A.该原电池的正极反应是:Zn-2e-=Zn2+ |
| B.左烧杯中溶液的红色逐渐褪去 |
| C.该电池铂电极上有气泡出现 |
| D.该电池总反应为:3Zn+2Fe3+=2Fe+3Zn2+ |
氯碱工业中关于电极材料的选用,下列说法合理的是 ( )。
| A.两极可用任意可导电固体材料 |
| B.阳极必须用惰性电极 |
| C.阴极必须用惰性电极 |
| D.石墨阳极比金属阳极更节电 |
某同学按如图所示的装置进行电解实验。下列说法正确的是( )。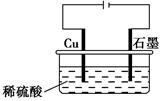
| A.电解过程中,铜电极上有H2产生 |
B.电解初期,主反应方程式为Cu+H2SO4 CuSO4+H2↑ CuSO4+H2↑ |
| C.电解一定时间后,石墨电极上有铜析出 |
| D.整个电解过程中,H+的浓度不断增大 |
