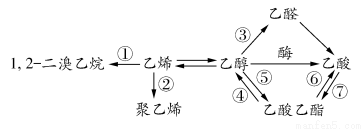
题目内容
某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空:
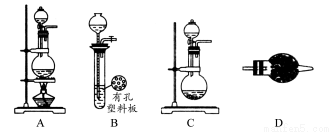
Ⅰ.探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与________(填装置编号)连接;装置C中的烧瓶内固体宜选用________。
a.碱石灰 b.氯化钙 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是________。
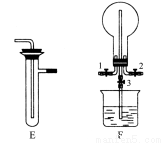
(3)装置F可用于探究氯气与氨气(已知氯气与氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应。实验时打开开关1、3,关闭2,先向烧瓶中通入________,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子________。
Ⅱ.探究某些物质的性质
(1)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是________。
(2)若利用装置A、E进行乙烯与溴水反应的实验,必须对装置A进行的改动是________。
(3)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。F的烧瓶中发生反应的化学方程式为________________;F的烧杯所起的作用是_________。
Ⅰ.(1)D a、d
(2)饱和食盐水、浓硫酸
(3)氯气 取少量固体于试管中,加入适量NaOH溶液并加热,在管口用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变蓝,证明固体中有NH4+
Ⅱ.(1)装置E中的NaBr溶液变橙红色
(2)向烧瓶中插入一只温度计,并使温度计水银球没入烧瓶内液面下
(3)SO2+2H2S=3S+2H2O 吸收尾气
【解析】Ⅰ.(1)氨气若用装置C制取,利用的是浓氨水与吸水剂反应,注意吸水剂不能与氨气反应,可选用碱石灰或生石灰。要获得干燥的氨气,可将气体通过碱石灰,故选D。(2)制取氯气的反应原理为浓盐酸与二氧化锰加热,若获得纯净、干燥的氯气,要先吸收挥发出来的HCl(通过饱和食盐水),再干燥(浓硫酸)。(3)开关3与液体相连,若先通氨气,易导致喷泉现象发生,另外,氯气为黄绿色气体,最后通氯气易干扰白烟现象的观察,故先通氯气后通氨气。NH4+的检验就是利用铵盐加碱并加热后生成可使湿润的红色石蕊试纸变蓝的气体。
Ⅱ.(1)比较Cl-和Br-的还原性强弱,可利用其对应单质间的置换反应,即氯气能将溴化钠溶液中的溴离子置换出来。(2)制取乙烯需要增加温度计,故应在烧瓶中插入一支温度计。(3)B生成H2S,C生成SO2,二者混合生成S和H2O,多余的气体有毒,可通入烧杯的碱液中吸收。

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案