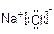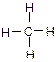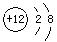题目内容
将FeSO4·a(NH4)2SO4·bH2O的晶体9.6g与过量的氯化钡溶液反应,生成11.417gBaSO4;然后加入足量浓NaOH溶液并加热,产生的氨气用100ml 1mol/L盐酸吸收,剩余的盐酸再用2mol/LNaOH溶液中和,需NaOH溶液25.5ml。则
(1)9.6g晶体中SO42—离子的物质的量是_________________________
(2)晶体化学式中a、b的值是(均取整数):a=________;b=____________
(1)9.6g晶体中SO42—离子的物质的量是_________________________
(2)晶体化学式中a、b的值是(均取整数):a=________;b=____________
(1)n(SO42-)=11.417g/233g.mol-=0.049mol
(2)n(NH4+)=0.01mol-0.0255L×2mol/L=0.049mol,由此推出(1+a)=2a,a=1;
晶体的摩尔质量="9.6g/0.0245mol=392" g.mol-
b=(392-152-132)/18=6
(2)n(NH4+)=0.01mol-0.0255L×2mol/L=0.049mol,由此推出(1+a)=2a,a=1;
晶体的摩尔质量="9.6g/0.0245mol=392" g.mol-
b=(392-152-132)/18=6
略

练习册系列答案
相关题目
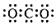
 好化学的基础。下列化学用语中正确的是 ( )
好化学的基础。下列化学用语中正确的是 ( )