题目内容
如图所示是一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,该工艺的原料的综合利用率较高.
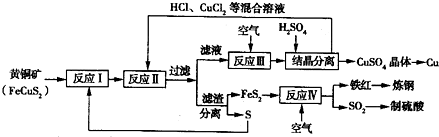
注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl-═2[CuCl2]-+S
请回答下列问题:
(1)反应Ⅰ的产物为 (填化学式),反应Ⅲ的离子方程式为 .
(2)一定温度下,向反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是 .
(3)反应Ⅳ的主要反应为4FeS2+11O2═2Fe2O3+8SO2,其中氧化产物为 ,当1.2g FeS2参与反应时,转移的电子数为 NA.
(4)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe(SO4)3溶液完全反应后,用0.02000mol/L K2Cr2O7,标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL.已知:Cr2
+Fe2++H+→Cr3++Fe3++H2O(未配平)
①SO2通入Fe(SO4)3溶液中,发生反应的离子方程式为 .
②反应Ⅳ所得气体中SO2的体积分数为 .

注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl-═2[CuCl2]-+S
请回答下列问题:
(1)反应Ⅰ的产物为
(2)一定温度下,向反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是
(3)反应Ⅳ的主要反应为4FeS2+11O2═2Fe2O3+8SO2,其中氧化产物为
(4)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe(SO4)3溶液完全反应后,用0.02000mol/L K2Cr2O7,标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL.已知:Cr2
| O | 2- 7 |
①SO2通入Fe(SO4)3溶液中,发生反应的离子方程式为
②反应Ⅳ所得气体中SO2的体积分数为
分析:(1)由流程可知,黄铁矿分解生成的Fe、Cu均为+2价;反应Ⅲ中生成铜离子;
(2)相同条件下硫酸铜的溶解度小;
(3)反应中Fe、S的化合价均升高,n(FeS2)=
=0.01mol,以此计算;
(4)①发生氧化还原反应生成硫酸亚铁;
②利用14H++Cr2O72-+6Fe2+═2Cr3++6Fe3++7H2O、SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,可知,3SO2~Cr2O72-,以此计算.
(2)相同条件下硫酸铜的溶解度小;
(3)反应中Fe、S的化合价均升高,n(FeS2)=
| 1.2g |
| 120g/mol |
(4)①发生氧化还原反应生成硫酸亚铁;
②利用14H++Cr2O72-+6Fe2+═2Cr3++6Fe3++7H2O、SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,可知,3SO2~Cr2O72-,以此计算.
解答:解:(1)由流程可知,黄铁矿分解生成的Fe、Cu均为+2价,则反应I的产物为FeS2、CuS,反应Ⅲ中生成铜离子,则离子反应为4CuCl2-+O2+4H+═4Cu2++8Cl-+2H2O,故答案为:FeS2、CuS;4CuCl2-+O2+4H+═4Cu2++8Cl-+2H2O;
(2)相同条件下硫酸铜的溶解度小,则该温度下,硫酸铜的溶解度小于氯化铜,所以向反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,
故答案为:该温度下,硫酸铜的溶解度小于氯化铜;
(3)反应中Fe、S的化合价均升高,氧化产物为Fe2O3、SO2,n(FeS2)=
=0.01mol,
转移的电子为0.01mol×(3-2)+0.01mol×2×[4-(-1)]=0.11mol,个数为0.11NA个,
故答案为:Fe2O3、SO2;0.11;
(4)①发生氧化还原反应生成硫酸亚铁,离子反应为SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,故答案为:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
②利用14H++Cr2O72-+6Fe2+═2Cr3++6Fe3++7H2O、SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,
可知,3SO2~Cr2O72-,
3 1
x 0.02mol/L×0.025L
解得x=0.0015mol,
反应Ⅳ所得气体中SO2的体积分数为
×100%=12.00%,故答案为:12.00%.
(2)相同条件下硫酸铜的溶解度小,则该温度下,硫酸铜的溶解度小于氯化铜,所以向反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,
故答案为:该温度下,硫酸铜的溶解度小于氯化铜;
(3)反应中Fe、S的化合价均升高,氧化产物为Fe2O3、SO2,n(FeS2)=
| 1.2g |
| 120g/mol |
转移的电子为0.01mol×(3-2)+0.01mol×2×[4-(-1)]=0.11mol,个数为0.11NA个,
故答案为:Fe2O3、SO2;0.11;
(4)①发生氧化还原反应生成硫酸亚铁,离子反应为SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,故答案为:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
②利用14H++Cr2O72-+6Fe2+═2Cr3++6Fe3++7H2O、SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,
可知,3SO2~Cr2O72-,
3 1
x 0.02mol/L×0.025L
解得x=0.0015mol,
反应Ⅳ所得气体中SO2的体积分数为
| 0.0015mol | ||
|
点评:本题以实际化工生产“黄铜矿的综合利用”为背景,考查了元素化合物知识,离子方程式和化学方程式的书写,题目更注重考查学生利用化学原理来解决实际问题的能力.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
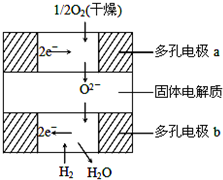
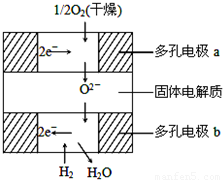
 如图所示是一种新近开发的固体氧化物燃料电池.它以掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体为固体电解质,在熔融状态下传导氧离子(O2-),其中多孔电极a、b均不参与电极反应.下列判断不正确的是( )
如图所示是一种新近开发的固体氧化物燃料电池.它以掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体为固体电解质,在熔融状态下传导氧离子(O2-),其中多孔电极a、b均不参与电极反应.下列判断不正确的是( )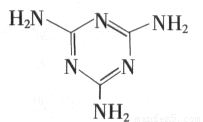
 A.三聚氰胺是一种蛋白质
A.三聚氰胺是一种蛋白质