题目内容
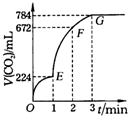
 用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况).下列分析正确的是( )
用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况).下列分析正确的是( )分析:A、相同时间内,生成的二氧化碳的体积越大,表明反应速率越快,据此结合图象判断;
B、由图可知EF段生成的二氧化碳体积为672mL-224mL=448mL,根据n=
计算二氧化碳的物质的量,根据方程式计算参加反应的HCl的物质的量,根据v=
计算盐酸表示该反应的平均反应速率;
C、随反应进行氢离子浓度降低,氢离子浓度变化使反应速率降低,由图象可知,EF段反应速率最快,说明反应为放热反应,EF短温度对反应速率起主要作用,FG段反应速率又降低,氢离子浓度起主要作用;
D、曲线上点的纵坐标的值即为该点收集的二氧化碳的体积.
B、由图可知EF段生成的二氧化碳体积为672mL-224mL=448mL,根据n=
| V |
| Vm |
| ||
| △t |
C、随反应进行氢离子浓度降低,氢离子浓度变化使反应速率降低,由图象可知,EF段反应速率最快,说明反应为放热反应,EF短温度对反应速率起主要作用,FG段反应速率又降低,氢离子浓度起主要作用;
D、曲线上点的纵坐标的值即为该点收集的二氧化碳的体积.
解答:解:A、由图可知,1min时间内,EF段生成的二氧化碳的体积最多,故EF段反应速率最快,故A错误;
B、由图可知EF段生成的二氧化碳体积为672mL-224mL=448mL,二氧化碳的物质的量为
=0.02mol,根据方程式
CaCO3+2HCl=CaCl2+CO2↑+H2O可知,△n(HCl)=2n(CO2)=2×0.02mol=0.04mol,故用盐酸表示该反应的平均反应速率为
=0.4mol/(L?min),故B错误;
C、随反应进行氢离子浓度降低,氢离子浓度变化使反应速率降低,由图象可知,1min时间内EF段生成的二氧化碳的体积最多,EF段反应速率最快,说明反应为放热反应,故C正确;
D、曲线上点的纵坐标的值即为该点收集的二氧化碳的体积,由图可知G点收集的二氧化碳最多,故D错误;
故选C.
B、由图可知EF段生成的二氧化碳体积为672mL-224mL=448mL,二氧化碳的物质的量为
| 0.448mL |
| 22.4L/L |
CaCO3+2HCl=CaCl2+CO2↑+H2O可知,△n(HCl)=2n(CO2)=2×0.02mol=0.04mol,故用盐酸表示该反应的平均反应速率为
| ||
| 2min-1min |
C、随反应进行氢离子浓度降低,氢离子浓度变化使反应速率降低,由图象可知,1min时间内EF段生成的二氧化碳的体积最多,EF段反应速率最快,说明反应为放热反应,故C正确;
D、曲线上点的纵坐标的值即为该点收集的二氧化碳的体积,由图可知G点收集的二氧化碳最多,故D错误;
故选C.
点评:考查反应速率的定量表示及有关图象,难度中等,注意根据速率定义式进行理解.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
 用纯净的CaCO3与稀盐酸反应制CO2,实验过程记录如图所示.根据分析判断正确的是( )
用纯净的CaCO3与稀盐酸反应制CO2,实验过程记录如图所示.根据分析判断正确的是( )| A、OE段表示反应速率最快 | B、EF段表示反应速率最快,收集的CO2最多 | C、FG段表示收集的CO2最多 | D、OG段表示随着时间的推移,反应速率逐渐增快 |
 用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积).下列分析正确的是( )
用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积).下列分析正确的是( )