题目内容
【题目】热化学方程式中的ΔH实际上是热力学中的一个物理量,叫做焓变,其数值和符号与反应物和生成物的总能量有关,也与反应物和生成物的键能有关。
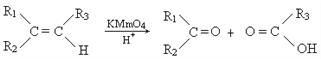
(1)图①是N2(g)和O2(g)反应生成NO(g)过程中的能量变化示意图,则该反应的热化学方程式为______________________;分析图②可知,若0.5 mol CO被氧化,放出Q kJ热量,则Q=________;若该反应是可逆反应,则在相同条件下将0.5 mol CO与1 mol NO2混合充分反应后放出的热量________Q kJ(填“>”“<”或“=”)。

(2)相关反应的热化学方程式如下:
CaSO4(s)+CO(g) ![]() CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ·mol-1(反应Ⅰ)
CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) ΔH2=-175.6 kJ·mol-1(反应Ⅱ)
CaS(s)+4CO2(g) ΔH2=-175.6 kJ·mol-1(反应Ⅱ)
①反应Ⅰ 能够自发进行的反应条件是________________________________。
②假设某温度下,反应 Ⅰ 的速率(v1)大于反应 Ⅱ 的速率(v2),则下列反应过程能量变化示意图正确的是________。


(3)已知:①Fe2O3(s)+3CO(g) === 2Fe(s)+3CO2(g) ΔH=-25 kJ·mol-1,
②3Fe2O3(s)+CO(g) ===2Fe3O4(s)+CO2(g) ΔH=-47 kJ·mol-1,
③Fe3O4(s)+CO(g) ===3FeO(s)+CO2(g) ΔH=+19 kJ·mol-1。
请写出CO还原FeO的热化学方程式:__________________________________。
【答案】 N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1 117 < 高温 C FeO(s)+CO(g) ===Fe(s)+CO2(g) ΔH=-11 kJ·mol-1
【解析】(1)反应热等于断键吸收的能量和形成化学键所放出的能量的差值,根据图①可知N2(g)和O2(g)反应生成NO(g)的反应热为(946+498-2×632)kJ/mol=180kJ/mol,所以该反应的热化学方程式为N2(g)+O2(g)=2NO(g) ΔH=+180 kJ·mol-1;根据图像可知该反应的焓变△H=134kJ/mol-368kJ/mol=-234kJ/mol,所以热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234kJ/mol,因此若0.5 mol CO被氧化,放出的热量Q=0.5mol×234kJ/mol=117kJ;若该反应是可逆反应,由于不能完全转化,则在相同条件下将0.5 mol CO与1 mol NO2混合充分反应后放出的热量小于Q kJ。(2)①反应Ⅰ是吸热的熵值增加的反应,所以根据△G=△H-T△S<0时可以自发进行可知该反应能够自发进行的反应条件是高温。②反应Ⅰ为吸热反应,反应Ⅱ为放热反应,则A、D错误;反应 Ⅰ 的速率(v1)大于反应 Ⅱ 的速率(v2),这说明反应Ⅱ的活化能较大,则B错误、C正确,答案选C;(3)已知:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-25 kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47 kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+19 kJ·mol-1
依据盖斯定律①×3-(③×2+②)得到:6CO(g)+6FeO(s)=6Fe(s)+6CO2(g)△H=-66kJ/mol,因此热化学方程式为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-11kJ/mol。

 阅读快车系列答案
阅读快车系列答案