题目内容
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
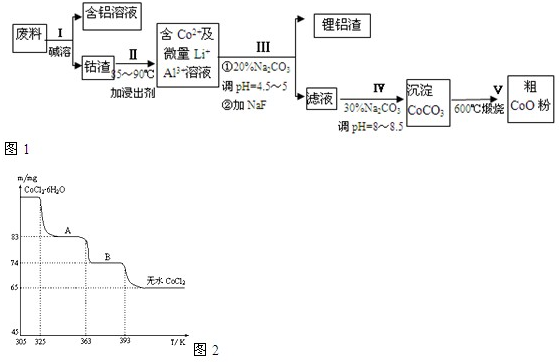
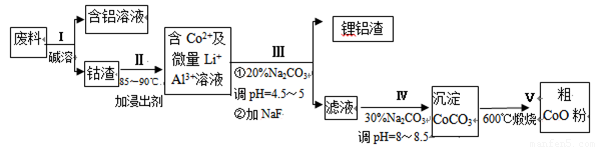
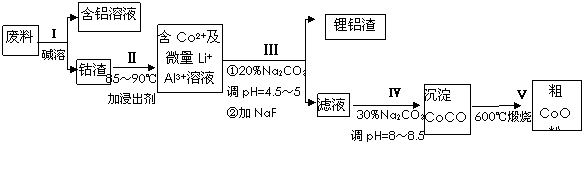
从废料中回收氧化钴(CoO)的工艺流程如下:

(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_______________。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式____________________。
(4)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是__________。
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是______(填序号)。
A.c(Na+) = 2c(CO32-)
B.c(Na+) > c(CO32-) > c(HCO3-)
C.c(OH-) > c(HCO3-) > c(H+)
D.c(OH-) - c(H+) = c(HCO3-) + 2c(H2CO3)
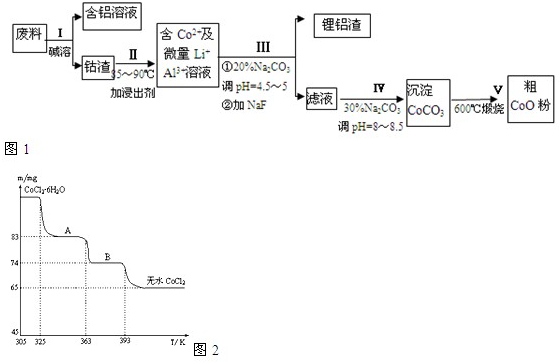
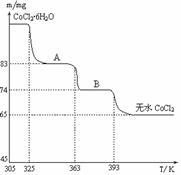
(6)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是______。
(共14分)
(1)2Al+2OH-+2H2O = 2AlO- 2+3H2↑
(2)4Co2O3·CoO + Na2S2O3 + 11H2SO4 = 12CoSO4 + Na2SO4 + 11H2O
Co2O3·CoO可氧化盐酸产生Cl2,污染环境。(合理即可)
(3)2Al3++3CO2- 3+3H2O = 2Al(OH)3↓+3CO2↑
(4)调整pH,提供CO2- 3,使Co2+沉淀为CoCO3
(5)B C D (有错不得分,答对2个得1分,全对得2分)
(6)CoCl2•2H2O
【解析】
试题分析:
(1)铝和氢氧化钠溶液反应:2Al+2OH-+2H2O = 2AlO2-+3H2↑
(2)①酸根应为硫酸根,根据溶液中离子可得方程式:4Co2O3·CoO + Na2S2O3 + 11H2SO4 = 12CoSO4 + Na2SO4 + 11H2O;盐酸中氯具有一定还原性,Co2O3·CoO可氧化盐酸产生Cl2,污染环境。
(3)发生双水解:2Al3++3 CO2- 3+3H2O = 2Al(OH)3↓+3CO2↑。
(4)调整pH,提供CO2- 3,使Co2+沉淀为CoCO3
(5)CO2- 3会部分水解:CO2- 3+H2O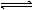 HCO3-+OH–,HCO3-+H2O
HCO3-+OH–,HCO3-+H2O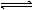 H2CO3+OH- A、 c(Na+)
>2c(CO2- 3),错误;B 、c(Na+) > c(CO2- 3) > c(HCO3-),正确;C 、c(OH-) > c(HCO3-)
> c(H+),正确;D、质子守恒: c(OH-)
- c(H+) = c(HCO3-) + 2c(H2CO3),正确。
H2CO3+OH- A、 c(Na+)
>2c(CO2- 3),错误;B 、c(Na+) > c(CO2- 3) > c(HCO3-),正确;C 、c(OH-) > c(HCO3-)
> c(H+),正确;D、质子守恒: c(OH-)
- c(H+) = c(HCO3-) + 2c(H2CO3),正确。
(6)最终无水的m(CoCl2)=65mg,M(CoCl2)=130g/mol,所以n(CoCl2)=0.5×10-3mol,从A到无水氯化钴减少m(H2O)=18mg, n(H2O)=1×10-3mol,可知N(CoCl2):N(H2O)=1:2,为CoCl2•2H2O。
考点:本题以工业流程为载体考查元素及其化合物性质、方程式书写、电解质溶液、化学计算等相关知识。。