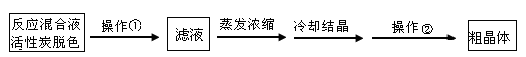
题目内容
绿矾(FeSO4·7H2O)可用于色谱分析剂、净水、照相制版等方面。下面是以铁屑(含少量锡等杂质)生产绿矾的一种方法:
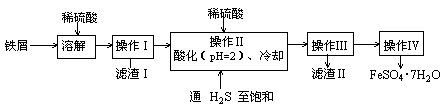
己知:在H2S饱和溶液中,SnS沉淀完全时的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时溶液的pH为5.5。
(1)操作Ⅱ中用pH试纸测定溶液pH的操作是:
(2)操作Ⅱ中用硫酸酸化至pH=2的目的是
(3)操作Ⅲ中需要的玻璃仪器是烧杯、 。
(4)通入硫化氢至饱和的目的是:①除去操作Ⅰ所得溶液中含有的Sn2+等杂质离子;
②
(5)操作IV的顺序依次为: 、冷却结晶、 。
(6)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;② 。

己知:在H2S饱和溶液中,SnS沉淀完全时的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时溶液的pH为5.5。
(1)操作Ⅱ中用pH试纸测定溶液pH的操作是:
(2)操作Ⅱ中用硫酸酸化至pH=2的目的是
(3)操作Ⅲ中需要的玻璃仪器是烧杯、 。
(4)通入硫化氢至饱和的目的是:①除去操作Ⅰ所得溶液中含有的Sn2+等杂质离子;
②
(5)操作IV的顺序依次为: 、冷却结晶、 。
(6)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;② 。
(1)将pH试纸放在干净、干燥的表面皿上,用干净、干燥的玻璃棒蘸取少量待测液滴在pH试纸中间,观察颜色并与比色卡比较
(2)使溶液中的Sn2+完全转化为SnS,而Fe2+不生成FeS沉淀
(3)玻璃棒、漏斗
(4)将溶液中的Fe3+离子转化为Fe2+离子
(5)蒸发浓缩 过滤 (6)降低绿矾的溶解度,减少绿矾的损失
试题分析:工艺流程题的关键是搞清楚加入什么物质,发生什么反应,如何分离。开始铁屑(Sn)加入硫酸溶解,转化为FeSO4、SnSO4等和不溶性杂质,通过过滤的方法将不溶性杂质除去;然后根据已知条件可知,调节pH在1.6~3.0,锡转化为SnS沉淀,而Fe2+在溶液中,从而通过过滤方法进行分离;FeSO4溶液,通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到FeSO4·7H2O晶体。

练习册系列答案
相关题目

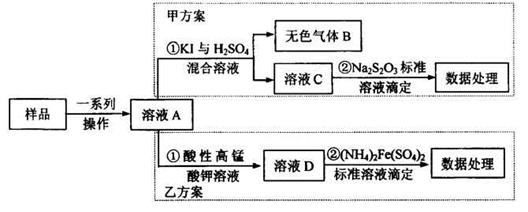
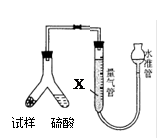
 Na2S2O3,常温下溶液中析出晶体为Na2S2O3?5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如右图所示。
Na2S2O3,常温下溶液中析出晶体为Na2S2O3?5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如右图所示。