题目内容
已知0.5mol烃A在氧气中充分燃烧可以生成88g CO2积45g H2O,且在一定条件下有如图所示反应关系(B、C分子中均只含一个官能团),下列有关说法中肯定不正确的是( )
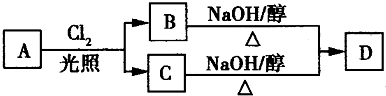

| A.A的分子式为C4H10 |
| B.B→D是消去反应 |
| C.若A是正丁烷,则8.C无法得到同一种物质D |
| D.B、C互为同分异构体 |
0.5mol烃A在氧气中充分燃烧可以生成88g CO2和45g H2O,
88g CO2的物质的量为
=2mol,45g H2O的物质的量为
=2.5mol,
故烃A中C原子数目为
=4,H原子数目为
=10,故烃A的分子式为C4H10,
A.由上述分析可知,A的分子式为C4H10,故A正确;
B.C4H10与氯气发生取代反应生成B,只含有1个官能团,B是一氯代烃,在氢氧化钠醇溶液、加热条件下发生消去反应生成D,故B正确;
C.若A是正丁烷,B、C分别为1-氯丁烷与2-氯丁烷,二者发生消去反应时可以得到同一物质1-丁烯,故C错误;
D.B、C的分子式相同,氯原子位置不同,互为同分异构体,故D正确;
故选C.
88g CO2的物质的量为
| 88g |
| 44g/mol |
| 45g |
| 18g/mol |
故烃A中C原子数目为
| 2mol |
| 0.5mol |
| 2.5mol×2 |
| 0.5mol |
A.由上述分析可知,A的分子式为C4H10,故A正确;
B.C4H10与氯气发生取代反应生成B,只含有1个官能团,B是一氯代烃,在氢氧化钠醇溶液、加热条件下发生消去反应生成D,故B正确;
C.若A是正丁烷,B、C分别为1-氯丁烷与2-氯丁烷,二者发生消去反应时可以得到同一物质1-丁烯,故C错误;
D.B、C的分子式相同,氯原子位置不同,互为同分异构体,故D正确;
故选C.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
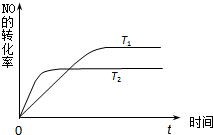 ①由此推知,反应 N2(g)+O2(g)?2NO(g)为(填“吸热”或“放热”)
①由此推知,反应 N2(g)+O2(g)?2NO(g)为(填“吸热”或“放热”)

