题目内容
4.将3m%的硫酸与同体积的m%的硫酸混合得到n%的稀硫酸,则m、n的关系正确的是( )| A. | n=2m | B. | n>2m | C. | n<2m | D. | 无法确定 |
分析 令质量分数为p%的硫酸的密度为dg/mL,3p%的硫酸的密度为Dg/mL,溶液体积为VmL,根据硫酸溶液的浓度愈大,其密度就愈大,则d<D,根据m=ρV表示出两硫酸溶液的质量,进而表示出混合后溶液总质量、溶质硫酸总的质量,再根据ω=$\frac{m(溶质)}{m(溶液)}$表示出混合后硫酸的质量分数,结合密度关系进行判断.
解答 解:令质量分数为m%的硫酸的密度为dg/mL,3m%的硫酸的密度为Dg/mL,溶液体积为VmL,
则混合后溶液的质量为:dg/mL×VmL+Dg/mL×VmL=V(d+D)g,
混合后溶质硫酸的总质量为:dg/mL×VmL×m%+Dg/mL×VmL×3m%=V(m%d+3m%D)g,
混合后硫酸的质量分数为:n%=$\frac{V(m%d+3m%D)g}{V(d+D)g}$=m%+$\frac{2m%D}{d+D}$=m%+2m%×$\frac{1}{1+\frac{d}{D}}$,
硫酸溶液的浓度愈大,其密度就愈大,则d<D,故1+$\frac{d}{D}$<2,则2m%×$\frac{1}{1+\frac{d}{D}}$>m%,故n%>2m%,即n>2m,
故选B.
点评 本题考主要考查了溶质质量分数的计算,难度中等,关键是清楚硫酸溶液、乙醇溶液浓度与质量分数关系,侧重考查对学生的数据处理能力,注意形成规律:1、两种溶质质量分数不同的同种溶液等质量混合时,混合后溶液的质量分数为稀浓溶液质量分数的平均值;2、对于溶液的密度大于1g/mL,溶质质量分数越大密度越大,浓、稀两种溶液等体积相混后,溶质质量分数大于平均值;3、对于溶液的密度小于1g/mL,溶质质量分数越大密度越小,浓、稀两种溶液等体积相混后,溶质质量分数小于平均值.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.生活中处处离不开化学.下列说法中,错误的是( )
| A. | 食用蔬菜、水果可补充维生素 | |
| B. | 适当补充钙元素可以预防甲状腺肿大 | |
| C. | 熟石灰可用于改良酸性土壤 | |
| D. | 生活污水处理后排放有利于保护环境 |
15.下列说法正确的是( )
| A. | 按系统命名法,化合物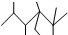 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等 | |
| C. | 苯和甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 结构片段 的高聚物是由加聚反应形成,其单体分子式为C7H60 的高聚物是由加聚反应形成,其单体分子式为C7H60 |
12.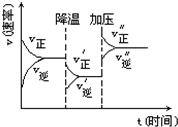 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )| A. | 若A、B是气体,则D是液体或固体 | B. | A、B、C、D均为气体 | ||
| C. | 逆反应是放热反应 | D. | 达平衡后,v(A)正=2 v(C)逆 |
16.国际理论与应用化学联合会(IUPAC)2012年5月正式确认了114号和116号元素并宣布其名称,其中关于${\;}_{116}^{292}$Lv的说法正确的是( )
| A. | 质量数为292 | B. | 中子数为116 | C. | 电子数为292 | D. | 质子数为176 |
 氧元素性质活泼,在众多的含氧化合物中氧元素显-2价,但也能形成一定数量的显正价的化合物.
氧元素性质活泼,在众多的含氧化合物中氧元素显-2价,但也能形成一定数量的显正价的化合物.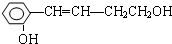 它能发生的反应是( )
它能发生的反应是( )