��Ŀ����
����Ŀ��ij��ѧ��ȤС�����ʵ�飬��Ũ������ͭ��Ӧ�Ƶ�SO2���������ʵ��̽����
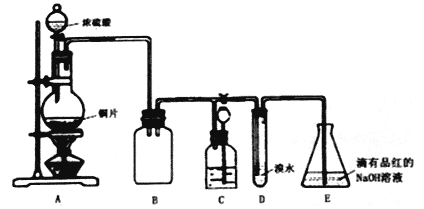
��1��װ��A�з�����Ӧ�Ļ�ѧ����ʽ��____________��װ��B��������____________��
��2�����װ��D��Ŀ������֤SO2��_____________�ԣ�E��NaOHȫ��ת��ΪNaHSO3�ı�־��____________��
��3��װ��C�������������������壬C��Ӧ���õ�Һ����________��
��4����Ӧ����ʱ��ƿ��Cu��ʣ�࣬ijͬѧ��ΪH2SO4Ҳ��ʣ�࣬�����������ʵ�鷽�����ⶨʣ��H2SO4����������ȴ������ϡ�ͺ��������ʵ�飬�ܴﵽĿ����________������ţ���
a��������к͵ζ����ⶨ b��������Zn��Ӧ����������H2�����
c����pH�Ʋ���ҺpHֵ d��������BaCl2��Һ��Ӧ���������ɳ���������
��5����Eƿ����NaHSO3��Һ�м���Ư����Һ����Ӧ�����ֿ��������
I�� HSO3-��ClO-�պ÷�Ӧ�ꣻ II�� Ư�۲��㣻 III�� Ư�۹���
ͬѧ�Ƿֱ�ȡ���������Һ���Թ��У�ͨ������ʵ��ȷ���÷�Ӧ������һ���������������±���
ʵ����� | ʵ����� | ���� | ��Ӧ�Ŀ������ |
�� | �μ��������۵⻯����Һ���� | III | |
�� | �μ������غ�ɫ��KI3��Һ���� | II | |
�� | �������������KMnO4��Һ���� | ��Һ����ɫ | |
�� | ���뼸С��CaCO3���� | �����ݲ��� |
��6������Ƽ�ʵ��֤��������HSO3-�ĵ���ƽ�ⳣ��Ka��ˮ��ƽ�ⳣ��Kb����Դ�С_________��
���𰸡���1��Cu��2H2SO4(Ũ)![]() CuSO4��SO2����2H2O����ֹ������
CuSO4��SO2����2H2O����ֹ������
��2����ԭ����ɫ��
��3��NaHSO3����4��abc��
��5������Һ��Ϊ��ɫ������Һ��ɫ���ۢ��������ܢ�������
��6�������£���pH��ֽ����pH�ƣ��ⶨNaHSO3��Һ��pH����pH��7����Ka��Kb����pH��7����Ka��Kb��
��������
�����������1��Cu��Ũ�����ϼ��ȣ�����������ԭ��Ӧ����������ͭ�����������ˮ����Ӧ�Ļ�ѧ����ʽ�ǣ�Cu��2H2SO4(Ũ)![]() CuSO4��SO2����2H2O��Bװ�õ���ƿ�ǿյģ����Է�ֹ��������ֹC��Һ�嵹����A�У������������ȫƿ������2����ˮ���������ԣ�����������л�ԭ�ԣ����߷���������ԭ��ӦBr2��SO2��2H2O=H2SO4��2HBr��D��NaOHȫ��ת��ΪNaHSO3����ͨ��SO2��Ʒ����Һ����ɫ���ʴ�Ϊ����ԭ����Һ��ɫ��ȥ����3��װ��C�������������������壬��װ����ʢ�е���Һ������SO2������Ӧ��C��Ӧ���õ�Һ����NaHSO3����4��a��������к͵ζ����ⶨ�����Բⶨ����Һ�к��е�H+�����ʵ������������ݵ���ʻ�ѧʽ�����ӹ�ϵ�����������������ʵ�������ȷ�� b������������Zn��Ӧ��Ӧ���������ݲ�������H2��������ɼ��������������ʵ�������ȷ��c����pH�Ʋ���ҺpHֵ��������Һ������Ϳ��Լ�����������ʵ�������ȷ��d�����������ἰ��Ӧ����������ͭ��������BaCl2��Һ��Ӧ���������ᱵ���������Բ��ܳ������ɳ��������������������������ʵ�����������5�������Ư�۹�����������ӦNaHSO3+Ca(ClO)2�TCaSO4��+NaCl+HClO������������������Ϊ�ⵥ�ʣ��������۱�������Һ��Ϊ��ɫ�������Ư�۹�����������Ӧ4NaHSO3+ Ca(ClO)2+CaCl2�T2CaSO4��+4NaCl+2SO2��+2H2O��SO2����I-ʹ��Һ��ɫ�������HSO3-��ClO-�պ÷�Ӧ�꣬����ʽΪNaHSO3+ Ca(ClO)2+CaCl2�T2CaSO4��+2NaCl+2HCl���������������KMnO4��Һ����Һ����ɫ��˵��û�л�ԭ�����ʣ���Ӧ�����Ǣ��ܼ��뼸С��CaCO3���壬����CO2���壬��Һ�����ԣ������Ǣ��ʴ�Ϊ������Һ��Ϊ��ɫ������Һ��ɫ���ۢ��ܢ���6��HSO3-����Һ�д��ڵ���ƽ�⣺HSO3-
CuSO4��SO2����2H2O��Bװ�õ���ƿ�ǿյģ����Է�ֹ��������ֹC��Һ�嵹����A�У������������ȫƿ������2����ˮ���������ԣ�����������л�ԭ�ԣ����߷���������ԭ��ӦBr2��SO2��2H2O=H2SO4��2HBr��D��NaOHȫ��ת��ΪNaHSO3����ͨ��SO2��Ʒ����Һ����ɫ���ʴ�Ϊ����ԭ����Һ��ɫ��ȥ����3��װ��C�������������������壬��װ����ʢ�е���Һ������SO2������Ӧ��C��Ӧ���õ�Һ����NaHSO3����4��a��������к͵ζ����ⶨ�����Բⶨ����Һ�к��е�H+�����ʵ������������ݵ���ʻ�ѧʽ�����ӹ�ϵ�����������������ʵ�������ȷ�� b������������Zn��Ӧ��Ӧ���������ݲ�������H2��������ɼ��������������ʵ�������ȷ��c����pH�Ʋ���ҺpHֵ��������Һ������Ϳ��Լ�����������ʵ�������ȷ��d�����������ἰ��Ӧ����������ͭ��������BaCl2��Һ��Ӧ���������ᱵ���������Բ��ܳ������ɳ��������������������������ʵ�����������5�������Ư�۹�����������ӦNaHSO3+Ca(ClO)2�TCaSO4��+NaCl+HClO������������������Ϊ�ⵥ�ʣ��������۱�������Һ��Ϊ��ɫ�������Ư�۹�����������Ӧ4NaHSO3+ Ca(ClO)2+CaCl2�T2CaSO4��+4NaCl+2SO2��+2H2O��SO2����I-ʹ��Һ��ɫ�������HSO3-��ClO-�պ÷�Ӧ�꣬����ʽΪNaHSO3+ Ca(ClO)2+CaCl2�T2CaSO4��+2NaCl+2HCl���������������KMnO4��Һ����Һ����ɫ��˵��û�л�ԭ�����ʣ���Ӧ�����Ǣ��ܼ��뼸С��CaCO3���壬����CO2���壬��Һ�����ԣ������Ǣ��ʴ�Ϊ������Һ��Ϊ��ɫ������Һ��ɫ���ۢ��ܢ���6��HSO3-����Һ�д��ڵ���ƽ�⣺HSO3-![]() H++SO32-������ʹ��Һ�����ԣ�ͬʱҲ����ˮ��ƽ�⣺HSO3-+H2O
H++SO32-������ʹ��Һ�����ԣ�ͬʱҲ����ˮ��ƽ�⣺HSO3-+H2O![]() H2SO3+OH-��ˮ��ʹ��Һ�Լ��ԣ���Ҫ��Ƽ�ʵ��֤��������HSO3-�ĵ���ƽ�ⳣ��Ka��ˮ��ƽ�ⳣ��Kb����Դ�С�����Բⶨ��Һ������Խ����жϣ������������£���pH��ֽ����pH�ƣ��ⶨNaHSO3��Һ��pH����pH��7����Ka��Kb����pH��7����Ka��Kb��
H2SO3+OH-��ˮ��ʹ��Һ�Լ��ԣ���Ҫ��Ƽ�ʵ��֤��������HSO3-�ĵ���ƽ�ⳣ��Ka��ˮ��ƽ�ⳣ��Kb����Դ�С�����Բⶨ��Һ������Խ����жϣ������������£���pH��ֽ����pH�ƣ��ⶨNaHSO3��Һ��pH����pH��7����Ka��Kb����pH��7����Ka��Kb��

 �����������һ��һ��ϵ�д�
�����������һ��һ��ϵ�д� Ӧ������ҵ��ϵ�д�
Ӧ������ҵ��ϵ�д�����Ŀ��ʵ������ijЩ�������ȡ���ռ���β������װ����ͼ��ʾ��ʡ���˾���װ���������ô�װ���ͱ����ṩ������������ʵ�飬�������ѡ������ ��
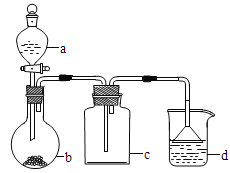
ѡ�� | a�е����� | b�е����� | c���ռ������� | d�е����� |
A | �Ȼ��� | NaOH | NH3 | H2O |
B | Ũ���� | MnO2 | Cl2 | NaOH��Һ |
C | ϡ���� | Cu | NO2 | H2O |
D | Ũ���� | Na2SO3 | SO2 | NaOH��Һ |