题目内容
在2L的密闭容器中发生反应3A+B 2C,若最初加入A、B的物质的量都是4mol,10s后达到平衡,若A的平均速率是0.12mol/(L?s),则平衡后容器中B的物质的量是( )
2C,若最初加入A、B的物质的量都是4mol,10s后达到平衡,若A的平均速率是0.12mol/(L?s),则平衡后容器中B的物质的量是( )
 2C,若最初加入A、B的物质的量都是4mol,10s后达到平衡,若A的平均速率是0.12mol/(L?s),则平衡后容器中B的物质的量是( )
2C,若最初加入A、B的物质的量都是4mol,10s后达到平衡,若A的平均速率是0.12mol/(L?s),则平衡后容器中B的物质的量是( )分析:10s后达到平衡,若A的平均速率是0.12mol/(L?s),则消耗A的物质的量为2L×10s×0.12mol/(L?s)=2.4mol,结合反应的化学方程式利用三段式法计算.
解答:解:10s后达到平衡,若A的平均速率是0.12mol/(L?s),则消耗A的物质的量为2L×10s×0.12mol/(L?s)=2.4mol,
3A+B 2C
2C
起始:4mol 4mol 0
转化:2.4mol 0.8mol 1.6mol
平衡:1.6mol 3.2mol 1.6mol
则平衡后容器中B的物质的量是3.2mol,
故选C.
3A+B
 2C
2C起始:4mol 4mol 0
转化:2.4mol 0.8mol 1.6mol
平衡:1.6mol 3.2mol 1.6mol
则平衡后容器中B的物质的量是3.2mol,
故选C.
点评:本题考查化学平衡的简单计算,题目难度不大,注意利用三段式法计算较为直观.

练习册系列答案
相关题目
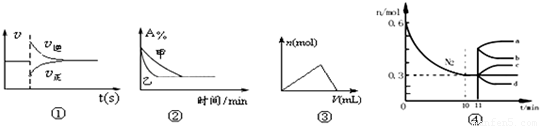
化学中常用图像直观地描述化学反应的进程或结果,下列图像描述正确的是 
| A.图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化 |
B.图②表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(g)的影响,且乙的压强大 3C(g)+D(g)的影响,且乙的压强大 |
| C.图③表示向Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液体积的关系 |
| D.图4表示在2L的密闭容器中发生合成氨反应时N2的物质的量随时间的变化曲线,0~10min内该反应的平均速率v(H2)=0.045mol·L-1·min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d |
化学中常用图像直观地描述化学反应的进程或结果,
下列图像描述正确的是
 |
A.图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B.图②表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(g)的影响,且甲的压强大
3C(g)+D(g)的影响,且甲的压强大
C.图③表示向Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液体积的关系
D.图4表示在2L的密闭容器中发生合成氨反应时N2的物质的量随时间的变化曲线,0~10min内该反应的平均速率v(H2)=0.045mol·L-1·min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d
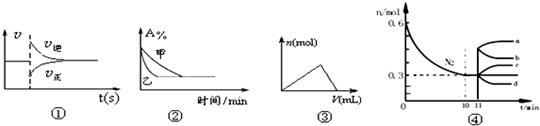

 3C(g)+D(g)的影响,且乙的压强大
3C(g)+D(g)的影响,且乙的压强大