题目内容
 氢气是中学化学中常见的气体之一,它是一中新型的绿色能源,又是一种重要的化工原料.
氢气是中学化学中常见的气体之一,它是一中新型的绿色能源,又是一种重要的化工原料.(1)氢气燃烧热值高.实验测得,在常温常压下,1gH2完全燃烧生成液态水,放出142.9kJ热量.则H2燃烧的热化学方程式为
(2)某同学利用铁与硫酸反应制取氢气,反应速率较慢,你认为可能的原因是:
(3)氢气是合成氨的重要原料.工业上合成氨的反应是:N2(g)+3H2(g)?2NH2(g)
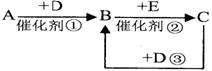
①一定条件下,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如右图所示,其中加入催化剂引起反应速率变化的时间段是
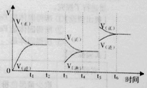
②温度为T℃时,将2a mol H2和 amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则该温度下反应的平衡常数为
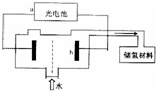
(4)利用光分解水制氢是未来解决能源危机的理想方法之一,某研究机构设计了如图的砷化镓光电池系统实现光分解水制氢.光电池的a极为
分析:(1)根据热化学反应方程式的书写规则书写,注意不要漏写各物质的状态.
(2)铁的纯度太高和氢离子浓度太大或太小都影响其反应速率.
(3)①催化剂能同等程度的改变正逆反应速率,据此分析.
②化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比.
(4)根据图分析,电解池中氢离子的阴极上放电生成氢气,阴极连接的是电源的负极,电解池的阳极连接的是电源的正极.
(2)铁的纯度太高和氢离子浓度太大或太小都影响其反应速率.
(3)①催化剂能同等程度的改变正逆反应速率,据此分析.
②化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比.
(4)根据图分析,电解池中氢离子的阴极上放电生成氢气,阴极连接的是电源的负极,电解池的阳极连接的是电源的正极.
解答:解:(1)1g氢气的物质的量是0.5mol,燃烧0.5mol氢气放出142.9kJ热量,所以燃烧1mol氢气放出285.8kJ热量,所以氢气的燃烧热化学反应方程式为:H2(g)+
O2(g)=H2O(1)△H=-285.8kJ/mol.
故答案为:H2(g)+
O2(g)=H2O(1)△H=-285.8kJ/mol.
(2)铁和硫酸反应时,如果铁的纯度较高,反应速率会较慢;如果溶液中氢离子浓度较低,反应速率会较慢;如果溶液中氢离子浓度太高,浓硫酸和铁能发生钝化现象,反应速率会较低.
故答案为:铁单质的纯度较高或硫酸浓度太稀或硫酸浓度太浓.
(3)①原来是平衡状态时,正逆反应速率相等,催化剂能同等程度的改变正逆反应速率,所以正逆反应速率还相等,且比原来速率大,即时间段是t2~t3.
故答案为t2~t3.
②N2(g)+3H2(g)?2NH2(g)
开始2amol/L 4amol/L 0
反应amol/L 3amol/L 2amol/L
平衡amol/L amol/L 2amol/L
所以化学平衡常数K=
=
故答案为
.
(4)根据图知,b极上生成氢气,所以在电解池中,氢离子在阴极上得到电子生成氢气,所以b极是阴极,b极连接的为电源的负极,所以a极是电源的正极;电解硫酸钠溶液,溶液中的水得电子生成氢气和氢氧根离子,电极反应式为 2H2O+2e-=H2↑+2OH-.
故答案为:正极; 2H2O+2e-=H2↑+2OH-.
| 1 |
| 2 |
故答案为:H2(g)+
| 1 |
| 2 |
(2)铁和硫酸反应时,如果铁的纯度较高,反应速率会较慢;如果溶液中氢离子浓度较低,反应速率会较慢;如果溶液中氢离子浓度太高,浓硫酸和铁能发生钝化现象,反应速率会较低.
故答案为:铁单质的纯度较高或硫酸浓度太稀或硫酸浓度太浓.
(3)①原来是平衡状态时,正逆反应速率相等,催化剂能同等程度的改变正逆反应速率,所以正逆反应速率还相等,且比原来速率大,即时间段是t2~t3.
故答案为t2~t3.
②N2(g)+3H2(g)?2NH2(g)
开始2amol/L 4amol/L 0
反应amol/L 3amol/L 2amol/L
平衡amol/L amol/L 2amol/L
所以化学平衡常数K=
| (2amol/L)2 |
| (amol/L).(amol/L)3 |
| 4 |
| a2 |
故答案为
| 4 |
| a2 |
(4)根据图知,b极上生成氢气,所以在电解池中,氢离子在阴极上得到电子生成氢气,所以b极是阴极,b极连接的为电源的负极,所以a极是电源的正极;电解硫酸钠溶液,溶液中的水得电子生成氢气和氢氧根离子,电极反应式为 2H2O+2e-=H2↑+2OH-.
故答案为:正极; 2H2O+2e-=H2↑+2OH-.
点评:本题考查了热化学反应方程式的书写、影响化学反应速率的因素等知识点,易错题是(1)题,注意写热化学反应方程式要注明各物质的状态,燃烧热的热化学反应方程式中燃料的计量数为1,然后根据原子守恒配平其它各物质即可.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目