��Ŀ����
�ҹ��Ǹ��������,���������������һλ,��¯��������Ϊ�ձ������������ij�ֿ�ʯ����Ԫ����������FemOn����ʽ����,�ֽ�������ʵ��:����������ʯ��Ʒ����,��ȡ25.0 g��Ʒ���ձ���,����ϡ�������ܽ�,�����ϼ��ȡ�����,��ȥ�������������Һ�м���10.0 gͭ�۳�ַ�Ӧ����ˡ�ϴ�ӡ������ʣ�����3.6 g��ʣ����Һ��2 mol��L-1������KMnO4�ζ�,���յ�ʱ����KMnO4��Һ���25.0 mL��
(1)���������ʯ����Ԫ�ص�����������
(2)����������FemOn�Ļ�ѧʽ(m��nΪ������)��
���𰸡�
(1)56%��(2)Fe5O7
��������(1)����8H++Mn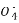 +5Fe2+
+5Fe2+ Mn2++5Fe3++4H2O��֪n(Fe2+)=5n(Mn
Mn2++5Fe3++4H2O��֪n(Fe2+)=5n(Mn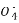 )=5��0.025 L��2 mol��L-1=0.25 mol,m(Fe)=14 g,����ʯ����Ԫ�ص���������=
)=5��0.025 L��2 mol��L-1=0.25 mol,m(Fe)=14 g,����ʯ����Ԫ�ص���������=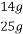 ��100%=56%;(2)�μӷ�Ӧn(Cu)=
��100%=56%;(2)�μӷ�Ӧn(Cu)=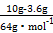 =0.1 mol,����2Fe3++Cu
=0.1 mol,����2Fe3++Cu 2Fe2++Cu2+��֪����ʯ��n(Fe3+)=0.2 mol��n(Fe2+)=0.25 mol-0.2 mol=0.05 mol,1������������Ӻ���һ��+2����ԭ��,����4��+3����ԭ��,���ݻ��ϼۿ�֪Oԭ��Ϊ7��
2Fe2++Cu2+��֪����ʯ��n(Fe3+)=0.2 mol��n(Fe2+)=0.25 mol-0.2 mol=0.05 mol,1������������Ӻ���һ��+2����ԭ��,����4��+3����ԭ��,���ݻ��ϼۿ�֪Oԭ��Ϊ7��

��ϰ��ϵ�д�
�����Ŀ