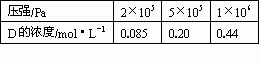题目内容
在10℃和2×105 Pa的条件下,反应aA(g)![]() dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(温度不变),下表列出了不同压强下反应建立平衡时物质D的浓度:
dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(温度不变),下表列出了不同压强下反应建立平衡时物质D的浓度:
根据表中的数据回答问题:
(1)压强从2×105 Pa增加到5×105 Pa时,平衡向________反应方向移动,其理由是________.
(2)压强从5×105 Pa增加到1×106 Pa时,平衡向________反应方向移动,其理由是________.
解析:
|
答案:(1)逆 压强增大2.5倍,假设平衡不发生移动,D的浓度应增大2.5倍,而实际D的浓度增大2.35倍,压强增大倍数大于D浓度增大倍数 (2)正 压强增大2倍,而D的浓度增大2.2倍,D浓度的增大倍数大于压强增大倍数,因此平衡右移,这只能是由于加压后E物质液化所致 解析:对气体物质而言,温度不变,气体的物质的量浓度与压强成正比.通常比较压强增大倍数与D浓度的增大倍数,可判断平衡移动的方向.分析题给数据,同样是加压,平衡移动的方向却相反,这就该想到,加压会引起物质状态的改变,使E物质液化,从而改变移动方向. |
提示:
|
解数字化化学题要加强数化信息的分析与综合. |

| |||||||||||
压强/Pa | 2×105 | 5×105 | 1×106 |
D的浓度/mol·L-1 | 0.085 | 0.20 | 0.44 |
根据表中数据,完成下列问题:
(1)压强从2×105 Pa增加到5×105 Pa时,平衡向_________(填“正”“逆”)反应方向移动,理由是__________________________。
(2)压强从5×105 Pa增加到1×106 Pa时,平衡向_________(填“正”“逆”)反应方向移动,理由是___________。平衡之所以向该反应方向移动,是由于____________________。
在10 ℃和2×105 Pa的条件下,反应aA(g) ![]() dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(温度维持不变)。下表列出了不同压强下反应建立平衡时物质D的浓度。
dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(温度维持不变)。下表列出了不同压强下反应建立平衡时物质D的浓度。
| 压强/Pa | 2×105 | 5×105 | 1×106 |
| D的浓度/mol·L-1 | 0.085 | 0.20 | 0.44 |
根据表中数据,回答下列问题:
(1)压强从2×105 Pa增加到5×105 Pa时,平衡向_________(填“正”“逆”)反应方向移动,理由是_______________________________。
(2)压强从5×105 Pa增加到1×106 Pa时,平衡向_______(填“正”“逆”)反应方向移动,理由是______。平衡之所以向该反应方向移动,是由于__________________。
Ⅰ.在条件为10 ℃和2×105 Pa的密闭容器中,反应aA(g) ![]() dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(温度维持不变)。下表列出了不同压强下反应建立平衡时物质D的浓度。
dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(温度维持不变)。下表列出了不同压强下反应建立平衡时物质D的浓度。
| 压强/Pa | 2×105 | 5×105 | 1×106 |
| D的浓度/mol?L-1 | 0.085 | 0.20 | 0.44 |
右图表示在10 ℃和2×105 Pa下,该反应进行过程中能量(单位为kJ/mol)的变化。
根据以上数据,回答下列问题:

(1)在10 ℃和2×105 Pa时,该反应的△H_____0, (填“>”或“<”)。
(2)压强从2×105 Pa增加到5×105 Pa时,平衡向_______(填“正”或“逆”)反应方向移动,理由是_______。
(3)压强从5×105 Pa增加到1×106 Pa时,平衡向_______(填“正”或“逆”)反应方向移动,理由是 。平衡之所以向该反应方向移动,是由于 。
Ⅱ.在温度t℃下,某NaOH的稀溶液中c(H+)=10―amol/L,c(OH―)=10―bmol/L,已知a+b=12,则该温度下水的离子积Kw= 。向该溶液中逐滴加入pH=c的盐酸(t℃),测得混合溶液的部分pH如下表所示。
| 序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 20.00 | 0.00 | 8 |
| ② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为 。
在10 ℃和2×105 Pa条件下,反应aA(g)![]() dD(g)+eE(g)建立平衡后,再逐步增加体系的压强(保持温度不变)。下表列出不同压强下反应建立平衡时物质D的浓度:
dD(g)+eE(g)建立平衡后,再逐步增加体系的压强(保持温度不变)。下表列出不同压强下反应建立平衡时物质D的浓度:
| 压强/Pa | 2×105 | 5×105 | 1×106 |
| D的浓度/mol·L-1 | 0.085 | 0.20 | 0.44 |
根据表中数据回答下列问题:
(1)压强2×105 Pa增加到5×105 Pa时,平衡向 反应方向移动(填“正”或“逆”),其理由是 。
(2)压强从5×105 Pa增加到1×106 Pa时,平衡向
反应方向移动(填“正”或“逆”),其理由是 。