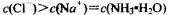题目内容
下列说法正确的是
| A.常温下,pH = 7的氨水与氯化铵的混合溶液中:c(Cl-) = c(NH4+) |
| B.常温下pH = 5的盐酸溶液稀释1000倍后pH = 8 |
| C.在BaSO4的饱和溶液中加入一定量Na2SO4固体,BaSO4的溶解度和Ksp均变小 |
| D.0.1 mol·L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) |
AD
试题分析:氨水与氯化铵的混合溶液中存在的四种离子是NH4+、H+、OH-、Cl-,根据电中性可得:c(H+)+c(NH4+)=c(Cl-)+c(OH-),混合溶液pH=7说明c(H+)=c(OH-),则c(NH4+)=c(Cl-),故A正确;盐酸显酸性,无论怎样稀释,稀释后溶液仍显酸性,pH只能无限地接近7,不可能大于等于7,故B错误;加入硫酸钠固体,增大硫酸根离子浓度,使BaSO4(s)
 Ba2++SO42-的平衡向逆反应方向移动,析出沉淀导致硫酸钡的溶解度减小,说明硫酸钡在水中的溶解度比在硫酸钠溶液中的溶解度大,但是Ksp只与温度有关,温度不变溶度积不变,故C错误;硫酸铵是强电解质,则(NH4)2SO4=2NH4++SO42-,不考虑水解时,铵根离子的浓度是硫酸根离子浓度的2倍,硫酸根离子不能水解,少部分铵根离子水解,导致溶液呈弱酸性,大部分铵根离子不水解,则溶液中铵根浓度介于硫酸根离子浓度的1~2倍之间,所以稀硫酸铵溶液中c(NH4+)>c(SO42-)>c(H+)>c(OH-),故D正确。
Ba2++SO42-的平衡向逆反应方向移动,析出沉淀导致硫酸钡的溶解度减小,说明硫酸钡在水中的溶解度比在硫酸钠溶液中的溶解度大,但是Ksp只与温度有关,温度不变溶度积不变,故C错误;硫酸铵是强电解质,则(NH4)2SO4=2NH4++SO42-,不考虑水解时,铵根离子的浓度是硫酸根离子浓度的2倍,硫酸根离子不能水解,少部分铵根离子水解,导致溶液呈弱酸性,大部分铵根离子不水解,则溶液中铵根浓度介于硫酸根离子浓度的1~2倍之间,所以稀硫酸铵溶液中c(NH4+)>c(SO42-)>c(H+)>c(OH-),故D正确。
练习册系列答案
相关题目
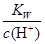 =0.1mol/L的溶液:Na+、K+、SiO32-、A1O2-
=0.1mol/L的溶液:Na+、K+、SiO32-、A1O2-