题目内容
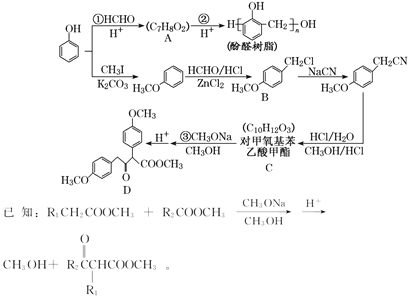
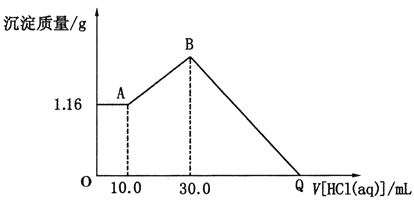
【题目】将NaOH、MgCl2、A1C13三种固体组成的混合物溶于足量水后得1.16g白色沉淀。在所得的浊液中逐滴加入1mo1·L-1HC1溶液,加入HC1溶液的体积与生成沉淀的质量关系如图所示,试回答:
(1)写出混合物溶于水时发生反应的离子方程式:_____________________________。
(2)写出AB段反应的离子方程式:_______________________________。
(3)原混合物中NaOH的物质的量是多少?(写出计算过程) ___________。
【答案】Mg2++2OH-=Mg(OH)2↓,Al3++4OH-=AlO2-+2H2O AlO2-+H++H2O=Al(OH)3↓ AB段消耗n(HCl)=1mol/L×(0.03L-0.01L)=0.02mol,根据Al守恒和离子反应AlO2-+H++H2O=Al(OH)3↓,n(AlCl3)=n(AlO2-)=n[Al(OH)3]=0.02mol,根据反应Al3++4OH-=AlO2-+2H2O,与AlCl3反应的NaOH物质的量为0.08mol;由镁元素的质量守恒可得n(MgCl2)=n[Mg(OH)2]=![]() =0.02mol,根据反应Mg2++2OH-=Mg(OH)2↓,与MgCl2反应的NaOH物质的量为0.04mol;与HCl反应的NaOH物质的量为1mol/L×0.01L=0.01mol;原混合物中NaOH物质的量为0.08mol+0.04mol+0.01mol=0.13mol。
=0.02mol,根据反应Mg2++2OH-=Mg(OH)2↓,与MgCl2反应的NaOH物质的量为0.04mol;与HCl反应的NaOH物质的量为1mol/L×0.01L=0.01mol;原混合物中NaOH物质的量为0.08mol+0.04mol+0.01mol=0.13mol。
【解析】
开始加入10mLHCl溶液,沉淀的质量既不增加也不减少,说明此时加入的10mL盐酸与NaOH反应,则NaOH、MgCl2、A1C13三种固体组成的混合物溶于足量水后所得1.16g白色沉淀全部为Mg(OH)2,溶液中为过量的NaOH和生成的NaAlO2、NaCl,故在此浊液中加入盐酸时,所发生的反应分为以下三个阶段:
开始到A点:H++OH-=H2O;
AB段:AlO2-+H++H2O=Al(OH)3↓;
BQ段:Mg(OH)2+2H+=Mg2++2H2O、Al(OH)3+3H+=Al3++3H2O,
据以上分析计算解答。
(1)开始加入10mLHCl溶液,沉淀的质量既不增加也不减少,说明此时加入的10mL盐酸与NaOH反应,当NaOH过量时,铝元素全部以AlO2-存在于溶液中,则原固体混合物溶于水后发生的反应有:MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+4NaOH=3NaCl+NaAlO2+2H2O,1.16g白色沉淀为Mg(OH)2;原固体混合物溶于水发生反应的离子方程式为:Mg2++2OH-=Mg(OH)2↓,Al3++4OH-=AlO2-+2H2O,故答案为:Mg2++2OH-=Mg(OH)2↓,Al3++4OH-=AlO2-+2H2O;
(2)在AB段随盐酸的加入,沉淀的量逐渐增多,所在发生的离子反应为:AlO2-+H++H2O=Al(OH)3↓,故答案为:AlO2-+H++H2O=Al(OH)3↓;
(3)AB段消耗n(HCl)=1mol/L![]() (0.03L-0.01L)=0.02mol,根据Al守恒和离子反应AlO2-+H++H2O=Al(OH)3↓,n(AlCl3)=n(AlO2-)=n[Al(OH)3]=0.02mol,根据反应Al3++4OH-=AlO2-+2H2O,与AlCl3反应的NaOH物质的量为0.08mol;由镁元素的质量守恒可得n(MgCl2)=n[Mg(OH)2]=
(0.03L-0.01L)=0.02mol,根据Al守恒和离子反应AlO2-+H++H2O=Al(OH)3↓,n(AlCl3)=n(AlO2-)=n[Al(OH)3]=0.02mol,根据反应Al3++4OH-=AlO2-+2H2O,与AlCl3反应的NaOH物质的量为0.08mol;由镁元素的质量守恒可得n(MgCl2)=n[Mg(OH)2]= ![]() =0.02mol,根据反应Mg2++2OH-=Mg(OH)2↓,与MgCl2反应的NaOH物质的量为0.04mol;与HCl反应的NaOH物质的量为1mol/L
=0.02mol,根据反应Mg2++2OH-=Mg(OH)2↓,与MgCl2反应的NaOH物质的量为0.04mol;与HCl反应的NaOH物质的量为1mol/L![]() 0.01L=0.01mol;原混合物中NaOH物质的量为0.08mol+0.04mol+0.01mol=0.13mol,故答案为:0.13mol。
0.01L=0.01mol;原混合物中NaOH物质的量为0.08mol+0.04mol+0.01mol=0.13mol,故答案为:0.13mol。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案