题目内容
下列各组溶液混合后,溶液一定呈中性的是( )A.等体积、等物质的量浓度的氨水与盐酸混合
B.室温下pH之和为14的氨水与硝酸等体积混合
C.室温下pH之和为14的Ba(OH)2溶液与NaHSO4溶液等体积混合
D.等体积、等物质的量浓度的Ca(OH)2溶液与Na2CO3溶液混合
【答案】分析:A、等体积、等物质的量浓度的氨水与盐酸混合,盐酸和氨水恰好反应生成氯化铵,根据氯化铵的类型判断溶液的酸碱性.
B、室温下,pH之和为14的氨水与硝酸,设硝酸的pH=a,硝酸中氢离子浓度=10-a mol/L,则氨水的pH=14-a,氨水中氢氧根离子浓度=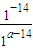 =10-a mol/L,氨水的物质的量浓度大于10-a mol/L,等体积混合,氨水的物质的量大于硝酸的物质的量.
=10-a mol/L,氨水的物质的量浓度大于10-a mol/L,等体积混合,氨水的物质的量大于硝酸的物质的量.
C、室温下,pH之和为14的14的Ba(OH)2溶液与NaHSO4溶液,氢离子浓度和氢氧根离子浓度相等,硫酸氢钠和氢氧化钡都是强电解质,所以氢离子和氢氧根离子恰好反应,据此判断溶液的酸碱性.
D、等体积、等物质的量浓度的Ca(OH)2溶液与Na2CO3溶液混合,生成碳酸钙和氢氧化钠,根据溶液中的溶质判断溶液的酸碱性.
解答:解:A、物质的量相等的盐酸和氨水混合,盐酸和氨水恰好反应生成氯化铵,氯化铵是强酸弱碱盐水解而使溶液呈酸性,故A错误.
B、室温下,pH之和为14的氨水与硝酸,酸中氢离子浓度和碱中氢氧根离子浓度相等,硝酸是强电解质,氨水是弱电解质,所以氨水的浓度远远大于氢氧根离子浓度,所以等体积的氨水和硝酸混合后,氨水过量,溶液呈碱性,故B错误.
C、室温下,pH之和为14的14的Ba(OH)2溶液与NaHSO4溶液,设硫酸氢钠溶液中氢离子浓度=10-a mol/L,则氢氧化钡的pH=14-a,氢氧化钡溶液中氢氧根离子浓度=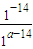 =10-a mol/L,硫酸氢钠和氢氧化钡都是强电解质,所以氢离子和氢氧根离子浓度相等,等体积混合,溶液呈中性,故C正确.
=10-a mol/L,硫酸氢钠和氢氧化钡都是强电解质,所以氢离子和氢氧根离子浓度相等,等体积混合,溶液呈中性,故C正确.
D、等物质的量的Ca(OH)2溶液与Na2CO3溶液混合,恰好反应生成碳酸钙和氢氧化钠,溶液呈碱性,故D错误.
故选C.
点评:本题考查酸碱混合的判断,题目难度不大,本题注意酸碱电解质的强弱以及盐类水解的酸碱性,特别是pH与溶液浓度的大小关系.
B、室温下,pH之和为14的氨水与硝酸,设硝酸的pH=a,硝酸中氢离子浓度=10-a mol/L,则氨水的pH=14-a,氨水中氢氧根离子浓度=
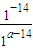 =10-a mol/L,氨水的物质的量浓度大于10-a mol/L,等体积混合,氨水的物质的量大于硝酸的物质的量.
=10-a mol/L,氨水的物质的量浓度大于10-a mol/L,等体积混合,氨水的物质的量大于硝酸的物质的量.C、室温下,pH之和为14的14的Ba(OH)2溶液与NaHSO4溶液,氢离子浓度和氢氧根离子浓度相等,硫酸氢钠和氢氧化钡都是强电解质,所以氢离子和氢氧根离子恰好反应,据此判断溶液的酸碱性.
D、等体积、等物质的量浓度的Ca(OH)2溶液与Na2CO3溶液混合,生成碳酸钙和氢氧化钠,根据溶液中的溶质判断溶液的酸碱性.
解答:解:A、物质的量相等的盐酸和氨水混合,盐酸和氨水恰好反应生成氯化铵,氯化铵是强酸弱碱盐水解而使溶液呈酸性,故A错误.
B、室温下,pH之和为14的氨水与硝酸,酸中氢离子浓度和碱中氢氧根离子浓度相等,硝酸是强电解质,氨水是弱电解质,所以氨水的浓度远远大于氢氧根离子浓度,所以等体积的氨水和硝酸混合后,氨水过量,溶液呈碱性,故B错误.
C、室温下,pH之和为14的14的Ba(OH)2溶液与NaHSO4溶液,设硫酸氢钠溶液中氢离子浓度=10-a mol/L,则氢氧化钡的pH=14-a,氢氧化钡溶液中氢氧根离子浓度=
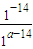 =10-a mol/L,硫酸氢钠和氢氧化钡都是强电解质,所以氢离子和氢氧根离子浓度相等,等体积混合,溶液呈中性,故C正确.
=10-a mol/L,硫酸氢钠和氢氧化钡都是强电解质,所以氢离子和氢氧根离子浓度相等,等体积混合,溶液呈中性,故C正确.D、等物质的量的Ca(OH)2溶液与Na2CO3溶液混合,恰好反应生成碳酸钙和氢氧化钠,溶液呈碱性,故D错误.
故选C.
点评:本题考查酸碱混合的判断,题目难度不大,本题注意酸碱电解质的强弱以及盐类水解的酸碱性,特别是pH与溶液浓度的大小关系.

练习册系列答案
相关题目
