题目内容
已知2H2(g)+O2(g)C3H8(g)+5O2(g) ![]() 3CO2(g)+4H2O △H=-2 220 kJ·mol-1??
3CO2(g)+4H2O △H=-2 220 kJ·mol-1??
设有氢气和丙烷的混合气体5 mol,完全燃烧时放出热量3 847 kJ,则混合气体中H2和丙烷的体积比是( )?
A.1∶3 B.3∶
解析:本题主要考查根据燃烧热计算反应物的组成。可以用三种解题方法解答本题:估算法,十字交叉法和列方程组求解法。?
解法一:假设二者的物质的量之比以1∶1混合,则2.5 mol丙烷燃烧放出的热已大于3 847 kJ,则A、C、D均不可能正确。?
解法二:已知:?
1 mol H2燃烧所放出的热量=![]() kJ·mol-1??
kJ·mol-1??
1 mol混合气体燃烧放出的热量=![]() kJ·mol-1??
kJ·mol-1??
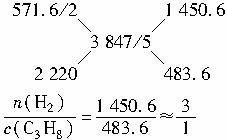
解法三:设混合气体H2、C3H8的物质的量分别为x、y?

解之:![]()
答案:B

练习册系列答案
相关题目




 则△H1>△H2
则△H1>△H2