题目内容
【题目】铬是用途广泛的金属,但在生产过程中易产生有害的含铬工业废水。
I、还原沉淀法是处理含Cr2O42— 和CrO72—工业废水的一种常用方法,其工艺流程如下:
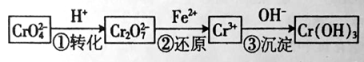
其中第①步存在平衡:2CrO42—(黄色)+2H+![]() Cr2O72— (橙色)+H2O
Cr2O72— (橙色)+H2O
(1)若平衡体系中,pH=0时溶液显 色。
(2)以石墨为电极,电解Na2CrO4制备Na2Cr2O7的装置如图所示。
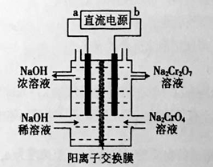
a极的名称是 ;b极直接相连一极的反应式为 。
(3)第②步反应的离子方程式: 。
第②步反应后的溶液加入一定量烧碱,若溶液中c(Fe3+)=2.0×10—12mol·L—1,则溶液中c(Cr3+)= mol·L—1。(已知Ksp[Fe(OH)3]=4.0×10—38 mol·L—1,Ksp[Cr(OH)3]=6.0x10—31 mol·L—1)。
II、探究CrO3的强氧化性和热稳定性
(4)CrO3遇有机物(如酒精)时猛烈反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。补充并配平下列反应式:
aCrO3+bC2H5OH+cH2SO4=dCr2(SO4)3+eCH3COOH+fR
b:c:f= 。
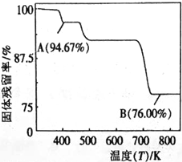
(5)CrO3的热稳定性差,加热时逐步分解,其固定残留率随温度的变化如图所示。B点时生成固体的化学式为 。(固体残留率= ![]() )
)
【答案】(1)橙;
(2)负极;2H2O―4e―=4H++O2↑;
(3)Cr2O72―+6Fe2++14H+=2Cr3++6Fe3++7H2O;3×10―5;
(4)1:2:3;
(5)Cr2O3;
【解析】
试题分析:(1)①若平衡体系的pH=2,溶液酸性较强,平衡2CrO42-(黄色)+2H+═Cr2O72- (橙色)+H2O正向移动,溶液呈橙色,故答案为:橙;
(2)根据2CrO42-+2H+ ![]() Cr2O72-+H2O设计图示装置,电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解生成H+提高溶液的酸性,说明该电极是阳极,连接电源的正极,则a电极为阴极,连接电源的负极,阳极的电极反应式为2H2O―4e―=4H++O2↑,故答案为:负极;2H2O―4e―=4H++O2↑;
Cr2O72-+H2O设计图示装置,电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解生成H+提高溶液的酸性,说明该电极是阳极,连接电源的正极,则a电极为阴极,连接电源的负极,阳极的电极反应式为2H2O―4e―=4H++O2↑,故答案为:负极;2H2O―4e―=4H++O2↑;
(3)亚铁离子与Cr2O72-发生氧化还原反应,反应的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,向Ⅱ反应后的溶液加一定量NaOH,若溶液中c(Fe3+)=2.0×10-12molL-1,则c(OH-)=![]() mol/L,c(Cr3+)=3×10-5,故答案为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;3×10-5;
mol/L,c(Cr3+)=3×10-5,故答案为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;3×10-5;
(4)CrO3具有强氧化性,遇到有机物(如酒精)时,乙醇被氧化成乙酸,碳的平均化合价从-2价升高到0,1个乙醇化合价变化4,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],铬的化合价从+6价降低到+3价,1个CrO3化合价变化3,两者的最小公倍数是12,再根据原子守恒得4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O,aCrO3+bC2H5OH+cH2SO4= dCr2(SO4)3+ eCH3COOH +fR中b:c:f=1:2:3故答案为:1:2:3;
(5)设固体质量为100g,B点时固体的质量为:100g×76%=76g,Cr的质量没有变,所以生成物中Cr的质量为52g,氧元素的质量为16,两者的个数比为![]() :
:![]() =2:3,所以B点时剩余固体的成分是Cr2O3,所以加热到 750K 时成分是Cr2O3,故答案为:Cr2O3。
=2:3,所以B点时剩余固体的成分是Cr2O3,所以加热到 750K 时成分是Cr2O3,故答案为:Cr2O3。