题目内容
18.锂碘电池的正极材料是聚2-乙烯吡啶(简写为P2VP)和I2的复合物,正极的电极反应式为P2VP•nI2+2Li++2e-=P2VP•(n-1)I2+2LiI,电解质是固态薄膜状碘化锂.下列说法正确的是( )| A. | P2VP和I2的复合物是绝缘体,不能导电 | |
| B. | 电池工作时,碘离子移向P2VP和I2的复合物 | |
| C. | 电池的总反应为2Li+P2VP•nI2═P2VP•(n-1)I2+2LiI | |
| D. | 若该电池所产生的电压较高,则该电池使用寿命比较长 |
分析 锂碘电池的正极的电极反应式为P2VP•nI2+2Li++2e-=P2VP•(n-1)I2+2LiI,负极反应式为2Li-2e-=2Li+,电极材料必须能够导电,原电池中阴离子移向负极,该电池的电势低,放电缓慢,使用寿命比较长,据此分析.
解答 解:A、正极材料是聚2-乙烯吡啶(简写为P2VP)和I2的复合物,电极不可能是绝缘体,故A错误;
B、原电池中碘离子移向负极Li,故B错误;
C、锂碘电池的正极的电极反应式为P2VP•nI2+2Li++2e-=P2VP•(n-1)I2+2LiI,负极反应式为2Li-2e-=2Li+,总反应为2Li+P2VP•nI2═P2VP•(n-1)I2+2LiI,故C正确;
D、该电池的电势低,放电缓慢,使用寿命比较长,故D错误;
故选C.
点评 本题考查了原电池原理,明确正负极、阴阳极上得失电子及电极反应是解本题关键,难点是电极反应式的书写,注意电池中离子的移动方向,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.下列关于胶体的叙述不正确的是( )
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径介于1nm--100nm之间 | |
| B. | 由于氢氧化铁胶体带正电荷,所以有电泳现象 | |
| C. | 向豆浆中加入盐卤做豆腐,利用了胶体的聚沉性质 | |
| D. | 将饱和FeCl3溶液滴入沸水中,并继续煮沸至红褐色液体,即为Fe(OH)3胶体 |
6.下列叙述正确的是( )
| A. | Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 | |
| B. | Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀 | |
| C. | 钠在常温下不容易被氧化 | |
| D. | 石蕊试液中加入Na2O2粉末,先变蓝后褪色,并有气泡生成 |
3.白磷有剧毒,白磷中毒可用硫酸铜溶液解毒,白磷与硫酸铜可以发生如下两个反应:
(1)2P+5CuSO4+8H2O═5Cu+2H3PO4+5H2SO4
(2)11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4
下列有关说法中错误的是( )
(1)2P+5CuSO4+8H2O═5Cu+2H3PO4+5H2SO4
(2)11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4
下列有关说法中错误的是( )
| A. | 在上述两个反应中,水既不是氧化剂也不是还原剂 | |
| B. | 在上述两个反应中,氧化产物都是H3PO4 | |
| C. | 在反应(2)中,当有5mol CuSO4发生反应时,共转移10mol电子 | |
| D. | 在上述两个反应中,氧化剂都只有硫酸铜 |
10.如表实验不能达到预期目的是( )
| 实验操作 | 实验目的 | |
| A. | 充满 NO2 的密闭玻璃球分别浸泡在冷、热水中 | 研究温度对化学平衡移动的影响 |
| B. | 向盛有 1mL 硝酸银溶液的试管中滴加 NaCl 溶液,至不再有沉淀,再向其中滴加 Na2S 溶液 | 说明一种沉淀能转化为另一种 溶解度更小的沉淀 |
| C. | 苯酚和水的浊液中,加少量浓碳酸钠溶液 | 比较苯酚与碳酸的酸性 |
| D. | 向2支试管中加入同体积同浓度H2C2O4溶液,再分别加入同体积不同浓度的酸性KMnO4溶 液 | 依据褪色时间来研究浓度对反 应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
8.对于0.1mol•L-1NH4Cl溶液,下列说法正确的是( )
| A. | 稀释后溶液pH降低 | B. | 通入少量HCl,c(NH4+)不变c(Cl-)增大 | ||
| C. | c(NH4+)+c(OH-)<c(Cl-)+c(H+) | D. | c(Cl-)>c(H+)>c(NH4+) |

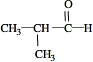
 R1COOH+R2COOH (R1、R2代表烃基)
R1COOH+R2COOH (R1、R2代表烃基)


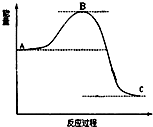 已知2SO2(g)十O2(g)$?_{催化剂}^{加热}$2SO3(g)反应过程的能量变化如图所示.请回答下列问题:
已知2SO2(g)十O2(g)$?_{催化剂}^{加热}$2SO3(g)反应过程的能量变化如图所示.请回答下列问题: