题目内容
(1)15.6gNa2R中含Na+0.4mol,则Na2R的摩尔质量为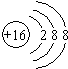
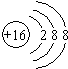 .
.
(2)
O、
O、
O、
H、
H、
H六种核素最多可以组成
H和
O组成的水分子,其中含中子数为
78/mol
78/mol
,画出R2-的离子结构示意图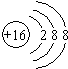
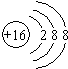
(2)
16 8 |
17 8 |
18 8 |
1 1 |
2 1 |
3 1 |
18
18
种水分子,现有22g由2 1 |
18 8 |
12
12
mol,电子数为10NA
10NA
个.分析:(1)根据Na2R的质量及钠离子的物质的量计算出Na2R的摩尔质量;根据摩尔质量计算出R的元素名称,画出R2-的离子结构示意图;
(2)根据水的组成是由氢、氧元素组成,在1个水分子中含有2个氢原子和1个氧原子来分析解答;根据中子数、电子数与分子数的关系计算.
(2)根据水的组成是由氢、氧元素组成,在1个水分子中含有2个氢原子和1个氧原子来分析解答;根据中子数、电子数与分子数的关系计算.
解答:解;(1)15.6gNa2R中含Na+0.4mol,Na2R的物质的量为0.2mol,Na2R的摩尔质量为:
=78g/mol,
Na2R的相对分子量为78,R的原子量为78-23×2=32,R为S元素,S2-的离子结构示意图为: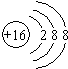 ,
,
故答案为:78g/mol;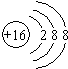 ;
;
(2)由氧的同位素有16O、17O、18O,氢的同位素有11H、12H、13H,在1个水分子中含有2个氢原子和1个氧原子,
若水分子中的氢原子相同,
则16O可分别与11H、12H、13H构成水,即存在三种水;
17O可分别与11H、12H、13H构成水,即存在三种水;
18O可分别与11H、12H、13H构成水,即存在三种水;
若水分子中的氢原子不同,
则16O可分别与11H12H、12H13H、11H13H构成水,即存在三种水;
17O可分别与11H12H、12H13H、11H13H构成水,即存在三种水;
18O可分别与11H12H、12H13H、11H13H构成水,即存在三种水;
所以共形成3×6=18种水,
现有22g由
H和
O组成的水分子,水分子的物质的量为:n=
=
=1mol,1mol该水中含有12mol中子,含有10mol电子,
故答案为:18;12;10NA.
| 15.6g |
| 0.2mol |
Na2R的相对分子量为78,R的原子量为78-23×2=32,R为S元素,S2-的离子结构示意图为:
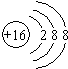 ,
,故答案为:78g/mol;
 ;
;(2)由氧的同位素有16O、17O、18O,氢的同位素有11H、12H、13H,在1个水分子中含有2个氢原子和1个氧原子,
若水分子中的氢原子相同,
则16O可分别与11H、12H、13H构成水,即存在三种水;
17O可分别与11H、12H、13H构成水,即存在三种水;
18O可分别与11H、12H、13H构成水,即存在三种水;
若水分子中的氢原子不同,
则16O可分别与11H12H、12H13H、11H13H构成水,即存在三种水;
17O可分别与11H12H、12H13H、11H13H构成水,即存在三种水;
18O可分别与11H12H、12H13H、11H13H构成水,即存在三种水;
所以共形成3×6=18种水,
现有22g由
2 1 |
18 8 |
| m |
| M |
| 22g |
| 22g/mol |
故答案为:18;12;10NA.
点评:本题考查了质子数、中子数、质量数、电子数之间的相互关系及离子结构示意图的画法,要注意分子的摩尔质量与质量数的关系,如:一般的H2O的摩尔质量为18g/mol,而2H218O的摩尔质量为22g/mol.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
硫元素具有可变价态,据此完成以下有关含硫化合物性质的试题.
(1)将H2S气体通入FeCl3溶液中,现象是 ;反应的离子方程式是 .
(2)为了探究-2价硫的化合物与+4价硫的化合物反应的条件,设计了下列实验.
已知:电离平衡常数:H2S K1=1.3×10-7;K2=7.1×10-15
H2SO3 K1=1.7×10-2;K2=5.6×10-8
①根据上述实验,可以得出结论:在 条件下,+4价硫的化合物可以氧化-2价硫的化合物.
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是 (选填编号).
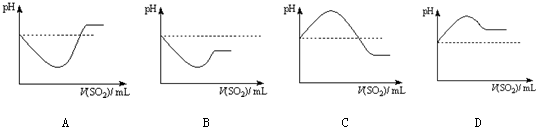
(3)现有试剂:溴水、硫化钠溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水.要证明Na2SO3具有还原性,应选用的试剂有 ,看到的现象是 .要证明Na2SO3具有氧化性,应选用的试剂有 ,反应的离子方程式是 .
(4)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应 .
(1)将H2S气体通入FeCl3溶液中,现象是
(2)为了探究-2价硫的化合物与+4价硫的化合物反应的条件,设计了下列实验.
| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
H2SO3 K1=1.7×10-2;K2=5.6×10-8
①根据上述实验,可以得出结论:在
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是

(3)现有试剂:溴水、硫化钠溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水.要证明Na2SO3具有还原性,应选用的试剂有
(4)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应