题目内容
实验室也可用KMnO4固体和浓盐酸反应制氯气,反应方程式如下:
2KMnO4+16HCl(浓)
2KCl+2MnCl2+8H2O+5Cl2↑.
完成下列问题:
(1)该反应中氧化剂是
(2)若反应中有0.5mol电子转移,被氧化的HCl的物质的量是多少?参加反应的高锰酸钾质量为多少?
2KMnO4+16HCl(浓)
| ||
完成下列问题:
(1)该反应中氧化剂是
KMnO4
KMnO4
,还原产物是MnCl2
MnCl2
.(2)若反应中有0.5mol电子转移,被氧化的HCl的物质的量是多少?参加反应的高锰酸钾质量为多少?
分析:(1)在氧化还原反应,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物;
(2)根据被氧化HCl和转移电子之间的关系式计算被氧化的HCl,根据转移电子和高锰酸钾之间的关系式计算参加反应的高锰酸钾的质量.
(2)根据被氧化HCl和转移电子之间的关系式计算被氧化的HCl,根据转移电子和高锰酸钾之间的关系式计算参加反应的高锰酸钾的质量.
解答:解:(1)该反应中,Mn元素化合价由+7价变为+2价,Cl元素化合价由-1价变为0价,所以高锰酸钾是氧化剂,部分氯化氢作还原剂,则氯化锰是还原产物,
故答案为:KMnO4;MnCl2;
(2)设被氧化的HCl的物质的量是x,参加反应的高锰酸钾的质量为y,
2KMnO4+10 HCl(浓)(被氧化)+6 HCl(浓)
2KCl+2MnCl2+8H2O+5Cl2↑ 转移电子数
316g 10mol 10mol
y x 0.5mol
=
,x=0.5mol;
=
,y=15.8g,
答:被氧化的HCl的物质的量有0.5mol,有15.8g KMnO4参加了反应.
故答案为:KMnO4;MnCl2;
(2)设被氧化的HCl的物质的量是x,参加反应的高锰酸钾的质量为y,
2KMnO4+10 HCl(浓)(被氧化)+6 HCl(浓)
| ||
316g 10mol 10mol
y x 0.5mol
| 10mol |
| x |
| 10mol |
| 0.5mol |
| 316g |
| y |
| 10mol |
| 0.5mol |
答:被氧化的HCl的物质的量有0.5mol,有15.8g KMnO4参加了反应.
点评:本题考查了氧化还原反应的有关计算,根据元素化合价变化结合方程式来分析解答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
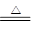 2KCl+2MnCl2+8H2O+5Cl2。
2KCl+2MnCl2+8H2O+5Cl2。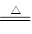 2KCl+2MnCl2+8H2O+5Cl2。
2KCl+2MnCl2+8H2O+5Cl2。