题目内容
(共9分,每空1分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)A为0.1mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为
。
(2)B为0.1mol·L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方
程式表示): ; ;
实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因:
。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入 ,目的是 ;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为
。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:
AgCl(S) Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp = 1.8×10-10
25℃时,现将足量氯化银分别放入:①100mL蒸馏水中;②100mL 0.2 mol·L-1AgNO3溶液中;③100mL 0.1 mol·L-1氯化铝溶液中;④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是 (填写序号);②中氯离子的浓度为 mol·L-1
(1)c(NH4+)>cSO42-)> c(H+)> c(OH-)
(2)HCO3-+H2O H2CO3+OH- HCO3-
H+ +CO32-
在溶液中HCO3-的水解程度大于电离程度,所以溶液呈碱性.
(3)HCl溶液 抑制Fe3+的水解,防止溶液变质.
Fe3++3HCO3- Fe(OH)3↓+3CO2↑(4)②>①>④>③ 9×10-10
解析:

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案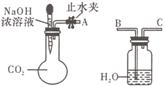 (每空1分,共9分)纯碱、烧碱等是重要的化工原料。
(每空1分,共9分)纯碱、烧碱等是重要的化工原料。
(1)利用如图所示装置可证明二氧化碳与烧碱溶液发生了
反应。将A与B连接,打开止水夹,将胶头滴管中的液体
挤入烧瓶,此时的实验现象是______________________。若其
它操作不变,将A与C连接,可观察到的现象是__________________________________________。
![]() (2)向100mL 2mol/L的NaOH溶液中通入一定量的CO2,结晶,得到9.3g白色固体,该白色固体
(2)向100mL 2mol/L的NaOH溶液中通入一定量的CO2,结晶,得到9.3g白色固体,该白色固体![]() 的组成是_______(写化学式)。设计实验确认该白色固体中存在的阴离子,试完成下列方案:
的组成是_______(写化学式)。设计实验确认该白色固体中存在的阴离子,试完成下列方案:
| 实验操作 | 实验现象 | 结 论 |
| ①取少量白色固体于试管中,加水溶解,再加足量BaCl2溶液 | ||
| ②过滤,取2mL滤液于试管中,滴加酚酞 | 溶液变红 |
(3)现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
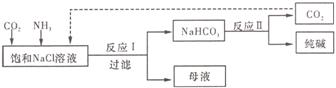
![]() 已知NaHCO3在低温
已知NaHCO3在低温![]() 下溶解度较小。反应Ⅰ为:NaCl+CO2+NH3+H2O
下溶解度较小。反应Ⅰ为:NaCl+CO2+NH3+H2O
NaHCO3↓+NH4Cl,处理母液的两种方法如下:
①向母液中加入石灰乳,可将其中______循环利用,同时得到融雪剂_____。
②向![]() 母液中通入NH3,加入细小食盐颗粒并降温,可得到NH4Cl晶体。
母液中通入NH3,加入细小食盐颗粒并降温,可得到NH4Cl晶体。
试写出通入NH3后,溶解度较小的酸碳酸盐转变为溶解度较大的碳酸盐的离子方程式_________________________________。
(每空1分,共9分)纯碱、烧碱等是重要的化工原料。
(1)利用如图所示装置可证明二氧化碳与烧碱溶液发生了
反应。将A与B连接,打开止水夹,将胶头滴管中的液体
挤入烧瓶,此时的实验现象是______________________。若其
它操作不变,将A与C连接,可观察到的现象是__________________________________________。 (2)向100mL 2mol/L的NaOH溶液中通入一定量的CO2,结晶,得到9.3g白色固体,该白色固体
(2)向100mL 2mol/L的NaOH溶液中通入一定量的CO2,结晶,得到9.3g白色固体,该白色固体 的组成是_______(写化学式)。设计实验确认该白色固体中存在的阴离子,试完成下列方案:
的组成是_______(写化学式)。设计实验确认该白色固体中存在的阴离子,试完成下列方案:
| 实验操作 | 实验现象 | 结 论 |
| ①取少量白色固体于试管中,加水溶解,再加足量BaCl2溶液 | | |
| ②过滤,取2mL滤液于试管中,滴加酚酞 | 溶液变红 | |

 已知NaHCO3在低温
已知NaHCO3在低温 下溶解度较小。反应Ⅰ为:NaCl+CO2+NH3+H2O
下溶解度较小。反应Ⅰ为:NaCl+CO2+NH3+H2O NaHCO3↓+NH4Cl,处理母液的两种方法如下:
①向母液中加入石灰乳,可将其中______循环利用,同时得到融雪剂_____。
②向
 母液中通入NH3,加入细小食盐颗粒并降温,可得到NH4Cl晶体。
母液中通入NH3,加入细小食盐颗粒并降温,可得到NH4Cl晶体。试写出通入NH3后,溶解度较小的酸碳酸盐转变为溶解度较大的碳酸盐的离子方程式_________________________________。