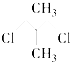
题目内容
【题目】Ⅰ、实验室可以用KMnO4固体和浓盐酸反应制取少量Cl2,反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O回答下列问题:
(1)该反应中被氧化的元素是__________.
(2)氧化性:KMnO4__________Cl2(填“>”、“<”或“=”)
(3)该反应中氧化剂和氧化产物的物质的量之比为__________.
(4)用双线桥法表示该反应中电子转移的方向和数目:_________
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
(5)每生成标准状况下2.24L Cl2,反应中转移电子的物质的量为__________.
Ⅱ、实验室常用以下方法制取氯气:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O请你根据所学知识回答下列问题:
MnCl2+Cl2↑+2H2O请你根据所学知识回答下列问题:
(1)把氯气通入紫色石蕊试液中,可以观察到的现象是:________________,请你解释其中的原因 __________________________________________________
(2)为保证实验安全,常用NaOH溶液吸收多余的氯气。写出反应的化学方程式__________________________________;
【答案】 Cl > 2:5 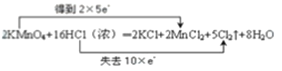 0.2mol 先变红后褪色 氯气和溶液中的水反应生成盐酸和次氯酸,石蕊遇酸变红色;同时次氯酸有漂白性,把变红色的石蕊漂白所以后褪色 Cl2+2NaOH=NaCl+NaClO+H2O
0.2mol 先变红后褪色 氯气和溶液中的水反应生成盐酸和次氯酸,石蕊遇酸变红色;同时次氯酸有漂白性,把变红色的石蕊漂白所以后褪色 Cl2+2NaOH=NaCl+NaClO+H2O
【解析】Ⅰ、(1)HCl中的Cl元素化合价由-1价升高到0价,被氧化,所以被氧化的元素为Cl。
(2)KMnO4是氧化剂,Cl2是氧化产物,氧化剂的氧化性大于氧化产物的氧化性,所以氧化性:KMnO4>Cl2。
(3)KMnO4全部做氧化剂,氧化产物是HCl,所以氧化剂和氧化产物的物质的量之比为2:5。
(4)反应中KMnO4为氧化剂,Mn元素的化合价由+7价降低到+2价,得到5个电子,Cl元素化合价由-1价升高到0价,被氧化,当有2molKMnO4参加反应,转移电子10mol,则电子转移的方向和数目用双线桥法表示如下: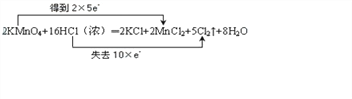 。
。
(5)每生成1molCl2转移2mol电子,标准状况下2.24L Cl2的物质的量为0.1mol,所以转移的电子的物质的量为0.1![]() 2mol=0.2mol。
2mol=0.2mol。
Ⅱ、(1) 氯气与水反应生成HCl和HClO,溶液呈酸性,紫色石蕊试液变红,HClO具有漂白性,把变红色的石蕊漂白。答案为:先变红后褪色、、氯气和溶液中的水反应生成盐酸和次氯酸,石蕊遇酸变红色,同时次氯酸有漂白性,把变红色的石蕊漂白所以后褪色。
(2)氯气有毒,不能随意排放,实验室常常用NaOH溶液吸收,发生的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O。

 阅读快车系列答案
阅读快车系列答案