题目内容
某种发动机燃料由A、B两种物质混合而成,A、B两种物质含有C、H、O三种元素中的两种或三种。已知常温下,A、B及CO、H2的燃烧热如下:物质 | A | B | CO | H2 |
燃烧热/kJ·mol-1 | 720 | 5 520 | 280 | 286 |
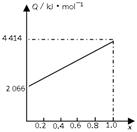
A、B按不同比例混合的燃料91.2 g,在足量的氧气中燃烧时,放出的热量Q与B的物质的量分数x的关系如上图。
(1)A、B的相对分子质量为A___________,B___________。
(2)等物质的量的A、B混合的燃料73 g,在160 L O2中完全燃烧,反应后气体通过浓硫酸后,得到104 L气体,通过碱石灰吸收后剩余3.2 L(气体体积均在标准状况下测定)。由此可推得:
A分子式为___________,B分子式为___________。
(3)1 mol等物质的量的A、B混合的燃料,在一定量的氧气中燃烧,放出热量2 980 kJ,则反应中生成CO___________ mol。
(1)32 114
(2)CH4O C8H18
(3)0.5
解析:燃料共91.2 g,据关系图知全为A时放热2 052 kJ。A燃烧热为720 kJ·mol-1,M(A)=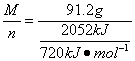 =32 g·mol-1。
=32 g·mol-1。
全为B时放热4 416 kJ,B燃烧热为5 520 kJ·mol-1。
M(B)= =114 g·mol-1。
=114 g·mol-1。
(1)A、B的相对分子质量为A为32,B为114。
(2)混合燃料73 g在160 L O2 中完全燃烧生成CO2和H2O,反应后气体通过浓H2SO4吸水余104 L,气体通过碱石灰吸收CO2,余3.2 L则为剩余O2体积,则n(CO2)=![]() =4.5 mol,共耗n(O2)=
=4.5 mol,共耗n(O2)=![]() =7 mol。
=7 mol。
73 g相当于各0.5 mol混合,若各1 mol则质量为146 g,n(C)=9 mol,耗O2为14 mol,可设子总组成为C9HxOy,据质量守恒及耗氧量守恒可列方程组
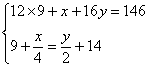
解得![]() ,即组成为C9H22O。
,即组成为C9H22O。
据含C、H、O三种元素中的两种或三种,且M(A)=32 g·mol-1,M(B)=114 g·mol-1,则A的分子式为CH4O,B的分子式为C8H18。
(3)1 mol等物质的量的A、B混合燃料,若完全燃烧则放热:
0.5 mol×(720 kJ·mol-1+5 520 kJ·mol-1)=3 120 kJ,实际放热2 980 kJ,现少放热:3 120 kJ-2 980 kJ=140 kJ。
CO燃烧热为280 kJ·mol-1,即每1 mol CO完全燃烧时放热280 kJ,即每有1 mol CO生成会少放出280 kJ热,现少放140 kJ,则反应中生成CO 0.5 mol。

 阅读快车系列答案
阅读快车系列答案已知常温下A、B及CO、H2的燃烧热如下:
1 mol物质 | A | B | CO | H2 |
燃烧热/kJ·mol-1 | 725 | 5518 | 283 | 286 |
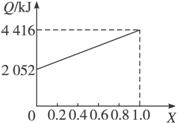
A、B不同比例混合的燃料91.2 g,在足量的氧气中燃烧时,放出的热量Q与混合燃料中B的物质的量分数x的关系如下图。(计算过程中保留两位小数)
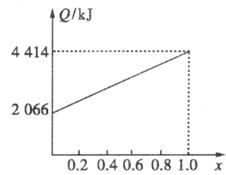
(1)相对分子质量A为_________,B为_________。
(2)73 g由A、B等物质的量混合而成的燃料在160 LO2中完全燃烧后,冷却后得到104 L气体,通过碱石灰充分吸收后剩余3.2 L(气体体积均在标准状况下测定)。由此可求得混合物中n(C):n(H):n(O)=_________,若A是醇,B为饱和烃,则A的分子式为_________,B分子式为_________。
(3)l mol由A、B等物质的量混合而成的燃料在一定量的氧气中燃烧,放出热量2 980 kJ,则反应中生成CO_________mol。
(10分)某种发动机燃料由A、B两种物质混合而成,A、B两种物质含有C、H、O三种元素中的两种或三种。已知常温下A、B及CO、H2的燃烧热如下:
| 物 质 | A | B | CO | H2 |
| 燃烧热/kJ·mol-1 | 725 | 5518 | 283 | 286 |
A、B按不同比例混合的燃料91.2g,在足量的氧气中燃烧时,放出的热量Q与B的物质的量分数x的关系如右图。
(1)A、B的相对分子质量为A________,B_______。
(2)等物质的量的A、B混合的燃料73g,在160LO2中完全燃烧,得到104L气体,通过碱石灰吸收后剩余3.2L(气体体积均在标准状况下测定)。由此可推得混合物中N(C)∶N(H)∶N(O)=_____________________,A分子式为__________________,B分子式为__________________。
(3)1mol等物质的量的A、B混合的燃料,在一定量的氧气中燃烧,放出热量2980kJ,则反应中生成CO________ mol。
(10分)某种发动机燃料由A、B两种物质混合而成,A、B两种物质含有C、H、O三种元素中的两种或三种。已知常温下A、B及CO、H2的燃烧热如下:
|
物 质 |
A |
B |
CO |
H2 |
|
燃烧热/kJ·mol-1 |
725 |
5518 |
283 |
286 |
A、B按不同比例混合的燃料91.2g,在足量的氧气中燃烧时,放出的热量Q与B的物质的量分数x的关系如右图。
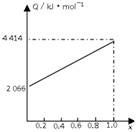
(1)A、B的相对分子质量为A________,B_______。
(2)等物质的量的A、B混合的燃料73g,在160LO2中完全燃烧,得到104L气体,通过碱石灰吸收后剩余3.2L(气体体积均在标准状况下测定)。由此可推得混合物中N(C)∶N(H)∶N(O)=_____________________,A分子式为__________________,B分子式为__________________。
(3)1mol等物质的量的A、B混合的燃料,在一定量的氧气中燃烧,放出热量2980kJ,则反应中生成CO________ mol。