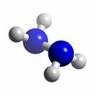
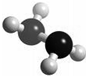
题目内容
肼(N2H4)分子中所示原子均达到稀有气体原子的稳定结构,它的沸点高达l13℃,燃烧热为642kJ?mol-1,肼与氧气及氢氧化钾溶液还可构成燃电池.已知肼的球棍模型如图所示,下列有关说法正确的是( )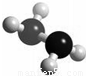
A.肼是由极性键和非极性键构成的非极性分子
B.肼沸点高达l13℃,可推测肼分子间可形成氢键
C.肼燃烧的热化学方程式为:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-642 kJ?mol-1
D.肼-氧气燃料电池,负极的电极反应为:O2+2H2O+4e-=4OH-
【答案】分析:A.肼为极性分子;
B.肼中含有N-H键,分子间能形成氢键;
C.根据燃烧热的定义分析;
D.正极反应为O2+2H2O+4e-=4OH-.
解答:解:A.肼分子中正负电荷重心不重叠,为极性分子,含有极性键和非极性键,故A错误;
B.肼中含有N-H键,分子间能形成氢键,沸点较高,故B正确;
C.肼的燃烧热为642kJ?mol-1,应生成液态水,故C错误;
D.正极反应为O2+2H2O+4e-=4OH-,负极为肼失电子被氧化,故D错误.
故选B.
点评:本题考查较为综合,题目难度中等,本题注意A,为易错点,不要简单地根据模型进行判断分子的极性.
B.肼中含有N-H键,分子间能形成氢键;
C.根据燃烧热的定义分析;
D.正极反应为O2+2H2O+4e-=4OH-.
解答:解:A.肼分子中正负电荷重心不重叠,为极性分子,含有极性键和非极性键,故A错误;
B.肼中含有N-H键,分子间能形成氢键,沸点较高,故B正确;
C.肼的燃烧热为642kJ?mol-1,应生成液态水,故C错误;
D.正极反应为O2+2H2O+4e-=4OH-,负极为肼失电子被氧化,故D错误.
故选B.
点评:本题考查较为综合,题目难度中等,本题注意A,为易错点,不要简单地根据模型进行判断分子的极性.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
肼(N2H4)分子中所有原子均达到稀有气体原子的稳定结构,它的沸点高达113℃,燃烧热为642 kJ·mol-1,肼与氧气及氢氧化钾溶液还可构成燃料电池。已知肼的球棍模型如图所示,下列有关说法正确的是( )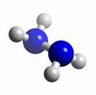
| A.肼是由极性键和非极性键构成的非极性分子 |
| B.肼沸点高达l13℃,可推测肼分子间能形成氢键 |
| C.肼燃烧的热化学方程式为:N2H4(g)+ O2(g) = N2(g) +2H2O(g);△H = -642 kJ·mol-1 |
| D.肼-氧气燃料电池,负极的电极反应为:O2 +2H2O+4e-=4OH- |
 肼(N2H4)分子中所示原子均达到稀有气体原子的稳定结构,它的沸点高达l13℃,燃烧热为642kJ?mol-1,肼与氧气及氢氧化钾溶液还可构成燃电池.已知肼的球棍模型如图所示,下列有关说法正确的是( )
肼(N2H4)分子中所示原子均达到稀有气体原子的稳定结构,它的沸点高达l13℃,燃烧热为642kJ?mol-1,肼与氧气及氢氧化钾溶液还可构成燃电池.已知肼的球棍模型如图所示,下列有关说法正确的是( )