题目内容
(12分)镍配合物在传感器、磁记录材料、储氢材料、电极催化剂和化学键研究等方面有着广泛的应用。以纯镍片为原料制备一种镍配合物[Ni(NH3)xCly]Clz·nH2O的主要流程如下:
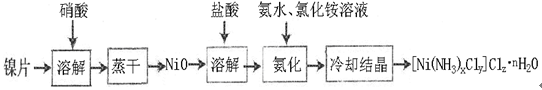
(1)工业上镍氢电池总反应式为:LaNi5H6 + NiOOH LaNi5 + Ni(OH)2,其中KOH作电解质溶液,负极电极反应式为:
LaNi5 + Ni(OH)2,其中KOH作电解质溶液,负极电极反应式为:
(2)常温下,镍投入60%的浓硝酸无明显现象,流程中需控制反应温度50-60oC,控温原因可能是 ,写出离子反应方程式: 。
(3)氨化过程中应控制溶液pH范围8~9,其原因是 。
上述流程中,有关说法正确的是( )
A.氨化操作为在过量氨水和氯化铵缓冲溶液中,缓慢滴入酸化的NiCl2溶液,并不断搅拌
B.此缓冲溶液中微粒浓度大小顺序为:c(Cl—)> c(NH3·H2O) >c(NH4+) > c(OH—)> c(H+)
C.冷却结晶后的母液加适量氨水调节pH后可以循环利用
D.可以用热的浓硫酸和浓硝酸混合溶液代替浓硝酸溶解镍片
(4)为测定化合物[Ni(NH3)xCly]Clz·nH2O的组成,进行如下实验:
实验一:称取样品0.6460 g,加入过量的浓NaOH溶液,煮沸,冷却,蒸出的氨用40.00 mL 0.5000 mol·L-1的盐酸完全吸收,并用蒸馏水定容至100 mL,得溶液B。取B溶液20.00 mL,加入指示剂少量,用0.1000 mol·L-1NaOH滴定,消耗NaOH溶液20.00 mL。
实验二:另取该样品0.6460 g,溶于水,以0.1000 mol·L-1AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00 mL。相应反应化学方程式为: [Ni(NH3)xCly]Clz+zAgNO3=
[Ni (NH3)xCly] (NO3)z+zAgCl↓ 测得该镍配合物的化学式为 。

(1)工业上镍氢电池总反应式为:LaNi5H6 + NiOOH
 LaNi5 + Ni(OH)2,其中KOH作电解质溶液,负极电极反应式为:
LaNi5 + Ni(OH)2,其中KOH作电解质溶液,负极电极反应式为: (2)常温下,镍投入60%的浓硝酸无明显现象,流程中需控制反应温度50-60oC,控温原因可能是 ,写出离子反应方程式: 。
(3)氨化过程中应控制溶液pH范围8~9,其原因是 。
上述流程中,有关说法正确的是( )
A.氨化操作为在过量氨水和氯化铵缓冲溶液中,缓慢滴入酸化的NiCl2溶液,并不断搅拌
B.此缓冲溶液中微粒浓度大小顺序为:c(Cl—)> c(NH3·H2O) >c(NH4+) > c(OH—)> c(H+)
C.冷却结晶后的母液加适量氨水调节pH后可以循环利用
D.可以用热的浓硫酸和浓硝酸混合溶液代替浓硝酸溶解镍片
(4)为测定化合物[Ni(NH3)xCly]Clz·nH2O的组成,进行如下实验:
实验一:称取样品0.6460 g,加入过量的浓NaOH溶液,煮沸,冷却,蒸出的氨用40.00 mL 0.5000 mol·L-1的盐酸完全吸收,并用蒸馏水定容至100 mL,得溶液B。取B溶液20.00 mL,加入指示剂少量,用0.1000 mol·L-1NaOH滴定,消耗NaOH溶液20.00 mL。
实验二:另取该样品0.6460 g,溶于水,以0.1000 mol·L-1AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00 mL。相应反应化学方程式为: [Ni(NH3)xCly]Clz+zAgNO3=
[Ni (NH3)xCly] (NO3)z+zAgCl↓ 测得该镍配合物的化学式为 。
(1)LaNi5H6 —6e—+6OH—==LaNi5 +6H2O,
(2)温度高于60oC浓硝酸易分解易挥发;温度低于50oC镍钝化阻止反应继续进行,且反应速率太慢。(前 1句1分,后一句1分。)
1句1分,后一句1分。)
Ni + 4H+ + 2NO3— Ni2+ + 2NO2↑+ 2H2O
Ni2+ + 2NO2↑+ 2H2O
(3)防止生成Ni(OH)2沉淀,使产品不纯(答到Ni(OH)2即可给分) AC
(4)[Ni(NH3)5Cl]Cl·6H2O
(2)温度高于60oC浓硝酸易分解易挥发;温度低于50oC镍钝化阻止反应继续进行,且反应速率太慢。(前
 1句1分,后一句1分。)
1句1分,后一句1分。)Ni + 4H+ + 2NO3—
 Ni2+ + 2NO2↑+ 2H2O
Ni2+ + 2NO2↑+ 2H2O(3)防止生成Ni(OH)2沉淀,使产品不纯(答到Ni(OH)2即可给分) AC
(4)[Ni(NH3)5Cl]Cl·6H2O
略

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
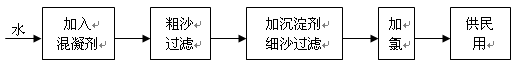
 HCl+HClO K=4.5×10-4
HCl+HClO K=4.5×10-4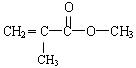 是甲基丙烯酸甲酯的结构简式。也可以写成CH2 = C(CH3)COOCH3。
是甲基丙烯酸甲酯的结构简式。也可以写成CH2 = C(CH3)COOCH3。 (CH3)2C(OH)CN
(CH3)2C(OH)CN CH2= C(CH3)COOCH3
CH2= C(CH3)COOCH3