题目内容
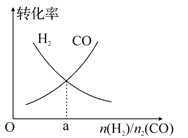
【题目】将V1 mL 1.00 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是( )
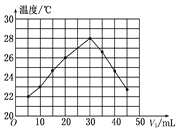
A. 做该实验时环境温度为22℃
B. NaOH溶液的浓度约为1.00 mol/L
C. 该实验表明有水生成的反应都是放热反应
D. 该实验表明化学能可以转化为热能
【答案】D
【解析】试题分析:A、根据图像知该实验开始温度是20℃,错误;B、根据图像知恰好反应时参加反应的盐酸的体积是30mL,由V1+V2=50mL可知,消耗的氢氧化钠溶液的体积为20mL,则c(HCl)V(HCl)=c(NaOH)V(NaOH),带入数据计算NaOH溶液的浓度为1.5 mol/L,错误;C、只是该反应放热,其他有水生成的反应不一定为放热反应,错误;D、由图示可以看出该反应过程放出热量,表明化学能可能转化为热能,正确。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】澳大利亚开发的质子流电池系统如图所示。下列说法正确的是
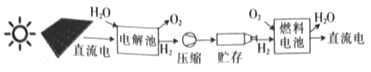
A. 电能是一次能源
B. 太阳能电池的供电原理与燃料电池相同
C. 图中能量转化方式只有2种
D. 燃料电池中的总反应为2H2+O2=2H2O
【题目】下表列出了有关晶体的说明,有错误的组合是( )
选项 | A | B | C | D |
晶体名称 | 碘化钾 | 干冰 | 氖 | 二氧化硅 |
组成晶体的微粒名称 | 阴、阳离子 | 分子 | 原子 | 原子 |
晶体内存在的结合力 | 离子键 | 范德华力 | 共价键 | 共价键 |
A.AB.BC.CD.D