题目内容
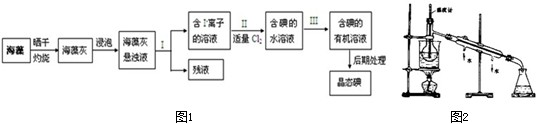
海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化钾的形式存在.从海带中提取碘是工业上获取碘的重要途径之一.其主要生产流程如图所示:

(1)过程①中使用海带粉而不是海带碎片的目的是:
(2)写出过程④中发生的主要化学反应方程式:
(3)过程⑥的操作Ⅰ是萃取,如在实验室进行此操作则用到的最主要的仪器是
(4)过程⑤所得碘的水溶液,不直接进行蒸发获取碘的理由是:
(5)过程⑦后得到了仍含少量固体杂质的碘单质,可通过升化的方法对其进行提纯,过程⑦操作Ⅱ是

(1)过程①中使用海带粉而不是海带碎片的目的是:
增加海带与水的接触,有利于碘化钾的溶解
增加海带与水的接触,有利于碘化钾的溶解
.(2)写出过程④中发生的主要化学反应方程式:
2I一+Cl2=I2+2Cl一
2I一+Cl2=I2+2Cl一
.(3)过程⑥的操作Ⅰ是萃取,如在实验室进行此操作则用到的最主要的仪器是
分液漏斗
分液漏斗
.(写名称),所选萃取剂一般是四氯化碳
四氯化碳
(选填:水或四氯化碳).(4)过程⑤所得碘的水溶液,不直接进行蒸发获取碘的理由是:
碘水溶液浓度太小,直接进行蒸发将消耗大量能量并需很长时间
碘水溶液浓度太小,直接进行蒸发将消耗大量能量并需很长时间
.(5)过程⑦后得到了仍含少量固体杂质的碘单质,可通过升化的方法对其进行提纯,过程⑦操作Ⅱ是
蒸发
蒸发
(填写操作名称).分析:(1)海带粉比海带碎片颗粒小;
(2)含碘离子溶液通入适量Cl2是为了将碘离子氧化成单质碘;
(3)萃取用到的仪器是分液漏斗,选择的能提取碘的试剂除了对I2有强的溶解能力处,还必须难溶于水,否则不能进行分液分离;
(4)碘水溶液浓度太小;
(5)萃取后得到的是四氯化碳和碘单质的溶液;
(2)含碘离子溶液通入适量Cl2是为了将碘离子氧化成单质碘;
(3)萃取用到的仪器是分液漏斗,选择的能提取碘的试剂除了对I2有强的溶解能力处,还必须难溶于水,否则不能进行分液分离;
(4)碘水溶液浓度太小;
(5)萃取后得到的是四氯化碳和碘单质的溶液;
解答:解:(1)海带粉比海带碎片颗粒小,表面积大,溶解容易,故答案为:增加海带与水的接触,有利于碘化钾的溶解;
(2)含碘离子溶液中加入氧化剂或通入适量Cl2可将碘离子氧化成单质碘,故答案为:2I一+Cl2=I2+2Cl一;
(3)萃取用到的仪器主要是分液漏斗;选择的能提取碘的试剂除了对I2有强的溶解能力处,还必须难溶于水,否则不能进行分液分离,符合条件的是四氯化碳,故答案为:分液漏斗;四氯化碳;
(4)碘水溶液浓度太小,直接进行蒸发将消耗大量能量并需很长时间,故答案为:碘水溶液浓度太小,直接进行蒸发将消耗大量能量并需很长时间;
(5)萃取后得到的是四氯化碳和碘单质的溶液,碘单质沸点较高,可用蒸发分离除掉四氯化碳,故答案为:蒸发;
(2)含碘离子溶液中加入氧化剂或通入适量Cl2可将碘离子氧化成单质碘,故答案为:2I一+Cl2=I2+2Cl一;
(3)萃取用到的仪器主要是分液漏斗;选择的能提取碘的试剂除了对I2有强的溶解能力处,还必须难溶于水,否则不能进行分液分离,符合条件的是四氯化碳,故答案为:分液漏斗;四氯化碳;
(4)碘水溶液浓度太小,直接进行蒸发将消耗大量能量并需很长时间,故答案为:碘水溶液浓度太小,直接进行蒸发将消耗大量能量并需很长时间;
(5)萃取后得到的是四氯化碳和碘单质的溶液,碘单质沸点较高,可用蒸发分离除掉四氯化碳,故答案为:蒸发;
点评:本题考查海带中碘单质的检验试验,题目难度不大,注意碘水溶液浓度太小,直接进行蒸发将消耗大量能量并需很长时间.

练习册系列答案
相关题目
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室从海藻中提取碘的流程如下:
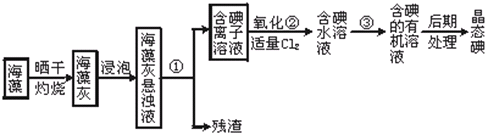
(1)指出提取碘的过程中有关实验操作名称 ① ③
(2)写出过程②中有关反应的离子方程式
(3)提取碘的过程中,可供选择的有机试剂是
A.乙酸 B.苯 C.四氯化碳 D.酒精

(1)指出提取碘的过程中有关实验操作名称 ①
(2)写出过程②中有关反应的离子方程式
(3)提取碘的过程中,可供选择的有机试剂是
A.乙酸 B.苯 C.四氯化碳 D.酒精
| 有机试剂 | 酒精 | 四氯化碳 | 苯 | 乙酸 |
| 毒性 | 无 | 无 | 有 | 无 |
| 水溶性 | 与水以任意比互溶 | 与水互不相溶 | 与水互不相溶 | 与水以任意比互溶 |