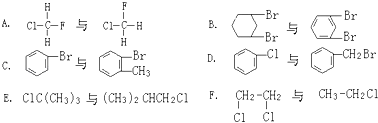题目内容
【题目】将a mol的铁铜混合物投入到200mL 2mol/L的稀HNO3中,充分反应后金属无剩余,下列说法正确的是( )
A.被还原的HNO3不可能是 ![]() mol
mol
B.溶液中剩余的n(NO3﹣)≤(0.4﹣ ![]() )mol
)mol
C.溶液中不可能同时存在Fe2+、Fe3+、Cu2+
D.被还原的硝酸为0.8a mol时,则溶液中一定含有Fe2+
【答案】B
【解析】解:当铁过量时:3Fe+8HNO3=3Fe(NO3)2+2NO+4H2O.①(铁失去2个电子) 当铁不过量时:Fe+4HNO3=Fe(NO3)3+2NO+4H2O.②(铁失去3个电子)
铜:3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O.③(铜失去2个电子)
∴若溶液中的铁是过量的,则amol的铜铁混合物便可看做一种物质(它们都只失2个电子),
A.∵在①③反应中,被还原硝酸的量为原硝酸量的 ![]() ,则∴被还原硝酸为
,则∴被还原硝酸为 ![]() amol×
amol× ![]() =
= ![]() amol,故A错误;
amol,故A错误;
B.由①②③可知,当铁过量时,溶液中剩余的硝酸根离子是最多的,∵当铁过量时,剩余的硝酸根离子的物质的量为:0.4mol﹣ ![]() amol,
amol,
∵铁不一定过量,∴溶液中剩余硝酸根离子的浓度≤0.4mol﹣ ![]() amol,故B正确;
amol,故B正确;
C.铁和稀硝酸的反应机理是:加入的铁先被硝酸还原成+3价,之后若铁还有剩余,三价铁离子又会和剩余铁单质反应,生成2价铁离子,
∴由此,只有在铁过量时,溶液中才可能同时出现2价和3价的铁离子,而在铁过量时,反应生成的3价铁离子会将未反应的铜单质和铁单质氧化,∴有可能使Fe2+、Fe3+、Cu2+同时存在,故C错误;
D.当消耗硝酸为0.8amol时,转移电子2.4amol,如金属全部为铁,且全部生成Fe3+ , 则转移3amol电子,如含有0.6amol铜,0.4amol铁,则全部反应生成Fe3+ , 就没有Fe2+ , 故D错误.
故选B.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】汽车尾气是造成雾霾天气的原因之一.
(1)汽车尾气中含有CO、NO2等有毒气体对汽车加装尾气净化装置可使有毒气体相互反应转化为无毒气体. 写出该反应的热化学方程式 .
N2(g)+2O2(g)═2NO2(g)△H=+68.0kJmol﹣1;
2C(s)+O2(g)═2CO(g)△H=﹣221.0kJmol﹣1;
C(s)+O2(g)═CO2(g)△H=﹣393.5kJmol﹣1
(2)汽车尾气中含有CO和H2O(g)在一定条件下可以发生反应
CO(g)+H2O(g)CO2(g)+H2(g)△H<0.850℃在体积为10L反应器中通入一定量的CO和H2O(g)发生上述反应CO和H2O(g)的浓度变化如图所示则0﹣4min是平均反应速率v(H2O)=此时K= .
起始物质的量 | 甲 | 乙 | 丙 |
n(H2O)/mol | 0.10 | 0.20 | 0.20 |
n(CO)/mol | 0.10 | 0.10 | 0.20 |
850℃在甲、乙、丙三个1L的恒容密闭容器中,起始时按照表进行投料,达到平衡状态.平衡时甲容器中CO的转化率是 . 比较下列容器中CO的转化率甲乙(填“大于”、“<”或“等于”).