题目内容
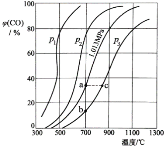
【题目】常温下PbSO4、PbCO3的溶度积常数分别为1.7×![]() 、7.4×
、7.4×![]() ,下列说法错误的是
,下列说法错误的是
A. PbSO4的饱和溶液中,c(Pb2+)约为1.3×![]()
![]()
B. 反应PbSO4(s)+CO32-(aq) ![]() PbCO3(s)+SO42-(aq)的平衡常数约为4.4×
PbCO3(s)+SO42-(aq)的平衡常数约为4.4×![]()
C. 向c(CO32-)=c(SO42-)的混合液中滴加Pb(NO3)2溶液,先得到PbCO3沉淀
D. PbCO3在水中的溶解度比在Pb(NO3)2溶液中的大
【答案】B
【解析】
A.PbSO4的饱和溶液中,c(Pb2+)= c(SO42-),c(Pb2+)× c(SO42-)=1.7×![]() 则c(Pb2+)≈1.3×
则c(Pb2+)≈1.3×![]()
![]() ,A项正确;
,A项正确;
B.反应PbSO4(s)+CO32-(aq) ![]() PbCO3(s)+SO42-(aq)的平衡常数
PbCO3(s)+SO42-(aq)的平衡常数![]() =
=![]() ≈2.3×105,B项错误;
≈2.3×105,B项错误;
C.由于PbSO4、PbCO3的组成形式相同而PbCO3溶度积较小,所以先生成沉淀的是PbCO3,C项正确;
D.Pb(NO3)2溶液中的Pb2+会使PbCO3的沉淀溶解平衡左移,从而减小其在水中的溶解量,D项正确;
所以答案选择B项。

【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
【题目】氮的化合物用途广泛。回答下列问题:
(1)在一定条件下,氮气能和水蒸气反应生成氨气和氧气2N2(g)+6H2O(g)=4NH3(g)+3O2(g)△H,与该反应相关的化学键键能数据如下:
化学键 | N≡N | H—O | N—H | O=O |
E(kJ/mol) | 946 | 463 | 391 | 496 |
则该反应的△H=________kJ·mol-1。
(2)在恒容密闭容器中充入2 mol N2O5与1molO2发生反应4NO2 (g) + O2 (g) ![]() 2N2O5 (g) △H。
2N2O5 (g) △H。
①已知在不同温度下测得N2O5的物质的量随时间的变化如图所示,该反应的△H_____0(填“>”“<”或“=”)。高温下该反应能逆向自发进行,其原因是___________________。
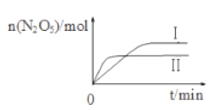
②下列有关该反应的说法正确的是_______(填标号)。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2 mol NO2和1molO2,再次达到平衡时,NO2的转化率增大
C.恒温恒容,当容器内的密度保持不变时,反应达到了平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图所示。则硼氢化钠燃料电池的负极反应式为_________。

(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.01molL—1的X、Y、Z、W溶液的pH。将X、Y、Z各1mol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为________。
0.01molL—1的溶液 | X | Y | Z | W |
pH | 12 | 2 | 8.5 | 4.5 |
(5)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I:2NO2(g)+NaCl(s) ![]() NaNO3 (s)+ClNO(g) K1
NaNO3 (s)+ClNO(g) K1
Ⅱ:2NO(g)+Cl2 (g) ![]() 2CNO(g) K2
2CNO(g) K2
①4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=____(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=____(用K1、K2表示)。
②在恒温条件下,向2L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10min时反应Ⅱ达到平衡,测得10min内v(ClNO)=7.5×10-3molL-1min-1,则平衡时NO的转化率α1=____;若其他条件不变,反应Ⅱ在恒压条件下进行,平衡时NO的转化率α2__α1(填“>”“<”或“=”)。