题目内容
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)
 CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6kJ·mol-1
CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6kJ·mol-1
CH3CH=CH2(g) CH4(g)+HC≡CH(g) △H2=+32.4kJ·mol-1
CH4(g)+HC≡CH(g) △H2=+32.4kJ·mol-1
则相同条件下,反应C3H8(g) CH3CH=CH2(g)+H2(g)的△H= kJ·mol-1。
CH3CH=CH2(g)+H2(g)的△H= kJ·mol-1。
(2)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5
mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3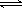 HCO3-+H+的电离平衡常数Ka1= 。(已知:10-5.60=2.5×10-6)
HCO3-+H+的电离平衡常数Ka1= 。(已知:10-5.60=2.5×10-6)
(3)在1 L浓度为c mol/LCH3COOH溶液中,CH3COOH分子、H+和CH3COO-离子物质的量之和为nc mol,则CH3COOH在该温度下的电离度为 ×100%
(6分)(1) 124.2(2分) (2)4.2×10-7; (2分) (3) n-1 (2分)
【解析】
试题分析:(1)根据盖斯定律可知,由①C3H8(g) CH4(g)+HC≡CH(g)+ H2(g) △H1=+156.6kJ/mol和②CH3CH=CH2(g)
CH4(g)+HC≡CH(g)+ H2(g) △H1=+156.6kJ/mol和②CH3CH=CH2(g) CH4(g)+ HC≡CH(g) △H2=+32.4kJ/mol,即①-②即得到C3H8(g)
CH4(g)+ HC≡CH(g) △H2=+32.4kJ/mol,即①-②即得到C3H8(g) CH3CH=CH2(g)+ H2(g),所以反应的反应热所以△H=△H1-△H2=+156.6kJ/mol-(+32.4kJ/mol)=+124.2kJ/mol。
CH3CH=CH2(g)+ H2(g),所以反应的反应热所以△H=△H1-△H2=+156.6kJ/mol-(+32.4kJ/mol)=+124.2kJ/mol。
(2)忽略水的电离及H2CO3的第二级电离,pH=5.60,则c(H+)=10-5.60=2.5×10-6mol/L,
由H2CO3 HCO3-+H+可知,平衡时c(H+)=c(HCO3-)=2.5×10-6mol/L,c(H2CO3)=(1.5×10-5-2.5×10-6)mol/L,则Ka=
HCO3-+H+可知,平衡时c(H+)=c(HCO3-)=2.5×10-6mol/L,c(H2CO3)=(1.5×10-5-2.5×10-6)mol/L,则Ka=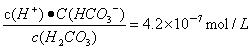 。
。
(3)设H+和CH3COO-离子物质的量都是x,则醋酸分子的物质的量是nc-2x,所以根据原子守恒可知nc-2x+x-c,解得x=nc-c。因此CH3COOH在该温度下的电离度为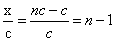 。
。
考点:考查盖斯定律的应用、弱电解质电离常数和电离度的计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和方法的指导,有利于培养学生的逻辑推理能力。该题的关键是明确明确盖斯定律、电离平衡常数和电离度的计算原理,然后灵活运用即可。

 HCO3-+H+的平衡常数K1=
HCO3-+H+的平衡常数K1= CO32-+H+,HCO3-+H2O
CO32-+H+,HCO3-+H2O H2CO3+OH-,
H2CO3+OH-,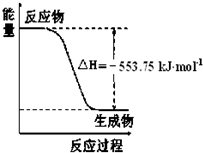 (1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总
(1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总