题目内容
原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2离子化合物。
(1)写出Y2O2的电子式 ;其中含有的化学键是
(2)X、Z、W三种元素的最高氧化物对应的水化物酸性最强的是(填写化学式):
;
(3)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是(填写化学式);
;
(4)与Z上下相邻的同主族元素M、N,原子电子层数M>Z>N,三种元素氢化物沸点由大到小的顺序是(填写化学式) > >
(5)元素Y的单质在一定条件下,能与氢气化合生成一种固态氢化物YH,熔点为800℃。
①YH晶体类型是
②YH能与水反应放氢气,写出化学方程式
③若将1molYH和1molAl混合加入足量水中,放出气体的体积是(标准状况下) L。
(1)写出Y2O2的电子式 ;其中含有的化学键是
(2)X、Z、W三种元素的最高氧化物对应的水化物酸性最强的是(填写化学式):
;
(3)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是(填写化学式);
;
(4)与Z上下相邻的同主族元素M、N,原子电子层数M>Z>N,三种元素氢化物沸点由大到小的顺序是(填写化学式) > >
(5)元素Y的单质在一定条件下,能与氢气化合生成一种固态氢化物YH,熔点为800℃。
①YH晶体类型是
②YH能与水反应放氢气,写出化学方程式
③若将1molYH和1molAl混合加入足量水中,放出气体的体积是(标准状况下) L。
(1)
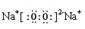 ;离子键、非极性键(每空1分,共2分)
;离子键、非极性键(每空1分,共2分)(2)HClO4(1分)
(3)NH3(1分)
(4)H2O>H2Se>H2S(2分)
(5)①离子晶体(2分)
②NaH+H2O=NaOH+H2↑(2分)
③56(2分)
本题综合考查元素周期律与化学键,元素化合物性质知识,考查内容有一定的层次性;解题的关键是根据氢化物确定元素在周期表中的族序数,由XH3、H2Z和HW三种共价化合物,可知,X在第VA族,Z在第VIA族,W在第VIIA族,Y可与氧气形成Y2O和Y2O2离子化合物,可推测Y为Na元素;由四种短周期元素原子序数依次增大,可确定X为N,Y为Na,Z为S,W为Cl;(1)Y2O2的电子式为
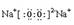 ;其中含有非极性共价键和离子键;(2)X、Z、W三种元素的最高氧化物对应的水化物酸性最强的是HClO4;(3)NH3是碱性气体,可与H2S,HCl反应;(4)根据题意,与Z上下相邻的同主族元素M为Se,N为O,三种元素氢化物分别为H2O 、H2Se、H2S,由于受氢键的影响,H2O的沸点高于H2S,所以三者的沸点由大到小为H2O>H2Se>H2S;(5)钠与氢形成的化合物为NaH,属于离子晶体;与水反应的方程式为NaH+H2O=NaOH+H2↑;由反应可知,1molNaH与水反应放出氢气22.4L,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,1molAl与水反应放出氢气33.6L,共产生气体56L。
;其中含有非极性共价键和离子键;(2)X、Z、W三种元素的最高氧化物对应的水化物酸性最强的是HClO4;(3)NH3是碱性气体,可与H2S,HCl反应;(4)根据题意,与Z上下相邻的同主族元素M为Se,N为O,三种元素氢化物分别为H2O 、H2Se、H2S,由于受氢键的影响,H2O的沸点高于H2S,所以三者的沸点由大到小为H2O>H2Se>H2S;(5)钠与氢形成的化合物为NaH,属于离子晶体;与水反应的方程式为NaH+H2O=NaOH+H2↑;由反应可知,1molNaH与水反应放出氢气22.4L,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,1molAl与水反应放出氢气33.6L,共产生气体56L。
练习册系列答案
相关题目