题目内容
【题目】石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯和综合应用流程如下:
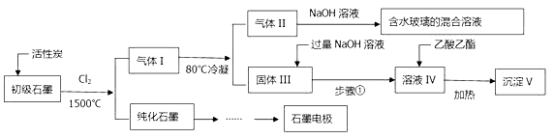
(注:SiCl4的沸点是57.6C,金属氯化物的沸点均高于150C)
(1)已知1mol石墨完全转化为金刚石需要吸收1.9kJ的能量。请写出石墨转化为金刚石的热化学反应方程式: _________________________。
(2)①向反应器中通入Cl2前,需通一段时间的N2。高温反应后,石墨中的氧化物杂质均转变为相应氯化物。80℃冷凝的目的是:_____________________。②由活性炭得到气体Ⅱ的化学反应方程式为:_____________________。
(3)加入过量NaOH溶液得到溶液IV的离子反应方程式为:_________________________。
(4)用化学反应原理解释得到沉淀V的过程中乙酸乙酯和加热的作用:________。1kg初级石墨最多可获得V的质量为_______________kg。
【答案】(1)C(石墨,S)=C(金刚石,S),△H=+1.9KJ/mol (3mol)
(2)将MgCl2、FeCl3、AlCl3等金属氯化物冷凝为固体,从而与SiCl4分开。(2分)
2C+SiO2+2Cl2![]() SiCl4+2CO 或2C+SiO2
SiCl4+2CO 或2C+SiO2![]() Si+2CO ,Si+2Cl2
Si+2CO ,Si+2Cl2![]() SiCl4(2分)
SiCl4(2分)
(3)Al3++4OH-=AlO2-+2H2O (2分)(4)溶液IV中NaAlO2水解呈碱性,乙酸乙酯消耗NaAlO2水解生成的碱,促进NaAlO2水解生成Al(OH)3;加热促进水解,加快反应的速率(3分);0.078(2分)
【解析】
试题分析:(1)根据题目中所给信息,热化学反应方程式为:C(石墨,S)=C(金刚石,S),△H=+1.9 kJ·mol-1;
(2)高温下,Si元素转化成SiCl4,铁元素转化成FeCl3,Mg元素转化成MgCl2,Al元素转化成AlCl3,SiCl4沸点是57.6℃,MgCl2、FeCl3、AlCl3沸点均高于150℃,加热到1500℃,MgCl2、FeCl3、AlCl3、SiCl4全部转化成气体I,80℃冷凝,SiCl4还是气体,而MgCl2、FeCl3、AlCl3状态是固体,便于与SiCl4分开;气体II中气体为SiCl4,因此发生的反应是SiO2+2C ![]() 2CO+Si,Si+Cl2
2CO+Si,Si+Cl2 ![]() SiCl4;
SiCl4;
(3)固体III是FeCl3、MgCl2、AlCl3,加入过量NaOH溶液发生离子反应是:Fe3++3OH-=Fe(OH)3↓、Mg2++2OH-=Mg(OH)2↓、Al3++4OH-=AlO2-+2H2O;
(4)AlO2-+2H2O![]() Al(OH)3+OH-,乙酸乙酯在碱中彻底水解,消耗OH-,促进水解,生成Al(OH)3,盐类水解是吸热反应,加热促进水解,加快反应速率;沉淀V是氧化铝,根据铝元素守恒,氧化铝的质量为:1000g×5.1%×2×10-3×78/102=0.078g。
Al(OH)3+OH-,乙酸乙酯在碱中彻底水解,消耗OH-,促进水解,生成Al(OH)3,盐类水解是吸热反应,加热促进水解,加快反应速率;沉淀V是氧化铝,根据铝元素守恒,氧化铝的质量为:1000g×5.1%×2×10-3×78/102=0.078g。

 备战中考寒假系列答案
备战中考寒假系列答案