题目内容
在实验室中,氮氧化物废气(主要成分NO2和NO)可以用NaOH溶液来吸收,以除去这些废气,其主要反应为:2NO2+2NaOH→NaNO2+NaNO3+H2O,NO+NO2+2NaOH→2NaNO2+H2O
(1)2molNO和2.4molNO2混合气体通入NaOH溶液被完全吸收时,生成的NaNO2 和 NaNO3物质的量各为多少?
(2)NO和NO2的混合气体的组成可表示为NOX,该混合气体通入NaOH溶液被完全吸收时,x的值可以为______(填编号).
a.1.1 b.1.2 c.1.5 d.1.8
若用纯碱溶液处理氮氧化物废气,反应与上述类似,同时放出CO2.
(3)请写出纯碱溶液吸收NO2的化学方程式______.
(4)现有标准状况下a升NO2(其中N2O4体积分数为20%)和b升NO的混合气恰好被200mL Na2CO3溶液完全吸收,则a、b应满足的关系为:______;该Na2CO3溶液的物质的量浓度为______ mol/L(用含a、b的代数式表示).
(5)若在标准状况下,2.016L氮氧化物的混合气和0.896LO2与1mol/LNa2CO3溶液50mL恰好反应生成NaNO3,则混和气体中N2O4与NO2的体积比为______.写出本小题的计算过程:______.
解:(1)、2molNO反应,需要消耗2molNO2,生成了4mol NaNO2,还有0.4mol NO2和氢氧化钠反应,分别生成0.2mol NaNO2、0.2mol NaNO3,故生成了4.2mol NaNO2,0.2mol NaNO2;
故答案是:n(NaNO2 )=4.2 mol n(NaNO3)=0.2 mol;
(2)由方程式可知,NO单独不能被吸收,NO和NO2混合气体被NaOH溶液被完全吸收,满足n(NO2):n(NO)≥1,当n(NO2):n(NO)=1时x值最小,x最小值为=1.5,因为混有NO,所以x最大值<2,故x的取值范围为1.5≤x<2,故选:CD;
(3))、二氧化氮与碳酸钠反应生成NaNO2、NaNO3、CO2,反应方程式为2NO2+Na2CO3=NaNO2+NaNO3+CO2 ,
故答案为:2NO2+Na2CO3=NaNO2+NaNO3+CO2 ;
(4)发生反应为:2NO2+Na2CO3=NaNO2+NaNO3+CO2 ,NO2+NO+Na2CO3=2NaNO2+CO2,从反应式就可以看出当n(NO2)/n(NO)≥1,气体就全部反应了,
aLNO2,其中N2O4的体积分数是20%,把N2O4折换成NO2,NO2的体积总共为aL×(1-20%)+aL×20%×2=1.2aL,所以 ≥1,
≥1,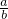 ≥
≥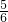 ;
;
由Na元素可知:2n(Na2CO3)=n(NaNO2)+n(NaNO3),由N元素守恒可知n(NaNO2)+n(NaNO3)=n(NO2)+2n(N2O4)+n(NO)= +
+ +
+ =
= mol,所以2n(Na2CO3)=
mol,所以2n(Na2CO3)= mol,n(Na2CO3)=
mol,n(Na2CO3)=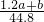 mol,该Na2CO3溶液的物质的量浓度为:
mol,该Na2CO3溶液的物质的量浓度为:
 =
=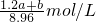 ;
;
故答案为: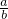 ≥
≥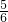 ;
;  ;
;
(5)、设:2.016 L氮氧化物中含N2O4 x mol、NO2 y mol、NO z mol,
x+y+z= =0.09
=0.09
2x+y+3z=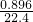 ×4 (得失电子守恒)
×4 (得失电子守恒)
2 x+y+z=0.05×2 (氮原子子守恒、钠离子守恒)
解得:x=0.01(mol),y=0.05(mol),z=0.03(mol)
∴V(N2O4):V(NO2)=n(N2O4):n(NO2)=0.01:0.05=1:5,
答:混和气体中N2O4与NO2的体积比为1:5,计算过程为:
设:2.016 L氮氧化物中含N2O4 x mol、NO2 y mol、NO z mol,x+y+z= =0.09
=0.09
2x+y+3z=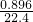 ×4 (得失电子守恒)
×4 (得失电子守恒)
2 x+y+z=0.05×2 (氮原子子守恒、钠离子守恒)
解得:x=0.01(mol),y=0.05(mol),z=0.03(mol)
∴V(N2O4):V(NO2)=n(N2O4):n(NO2)=0.01:0.05=1:5.
分析:(1)、NO必须和二氧化氮一起才能反应,根据反应分别求算出生成的NaNO2 和NaNO3,故NO2还剩余0.4mol单独与烧碱反应;(2)、由方程式2NO2+2NaOH=NaNO2+NaNO3+H2O和NO+NO2+2NaOH=2NaNO2+H2O可知,NO单独不能被吸收,NO和NO2混合气体被NaOH溶液被完全吸收,满足n(NO2):n(NO)≥1,当n(NO2):n(NO)=1时x值最小,计算x的最小值,因为混有NO,所以x最大值<2,据此确定x取值范围;
(3)、纯碱溶液处理氮氧化物废气,反应与上述类似,同时放出CO2,所以二氧化氮与碳酸钠反应生成NaNO2、NaNO3、CO2;
(4)、发生反应2NO2+Na2CO3=NaNO2+NaNO3+CO2,NO2+NO+Na2CO3=2NaNO2+CO2,从反应式就可以看出当n(NO2)/n(NO)≥1,把N2O4折换成NO2,计算a、b的关系;恰好反应溶液溶质为NaNO2、NaNO3,由N元素守恒可知n(NaNO2)+n(NaNO3)=n(NO2)+2n(N2O4)+n(NO),由Na元素可知2n(Na2CO3)=n(NaNO2)+n(NaNO3),计算n(Na2CO3)代入c=n/v,计算碳酸钠的浓度.
(5)、设2.016 L氮氧化物中含N2O4 x mol、NO2y mol、NO z mol,分别利用气体总物质的量、电子守恒、钠离子氮原子守恒列式求解.
点评:本题考查阅读理解信息的能力、混合反应的计算能力等,需要学生具备扎实的基础与利用信息、基础知识分析解决问题的能力,根据题给信息书写化学方程式,发现化学方程式中隐含的关系和规律是解题关键,难度稍大.
故答案是:n(NaNO2 )=4.2 mol n(NaNO3)=0.2 mol;
(2)由方程式可知,NO单独不能被吸收,NO和NO2混合气体被NaOH溶液被完全吸收,满足n(NO2):n(NO)≥1,当n(NO2):n(NO)=1时x值最小,x最小值为=1.5,因为混有NO,所以x最大值<2,故x的取值范围为1.5≤x<2,故选:CD;
(3))、二氧化氮与碳酸钠反应生成NaNO2、NaNO3、CO2,反应方程式为2NO2+Na2CO3=NaNO2+NaNO3+CO2 ,
故答案为:2NO2+Na2CO3=NaNO2+NaNO3+CO2 ;
(4)发生反应为:2NO2+Na2CO3=NaNO2+NaNO3+CO2 ,NO2+NO+Na2CO3=2NaNO2+CO2,从反应式就可以看出当n(NO2)/n(NO)≥1,气体就全部反应了,
aLNO2,其中N2O4的体积分数是20%,把N2O4折换成NO2,NO2的体积总共为aL×(1-20%)+aL×20%×2=1.2aL,所以
 ≥1,
≥1,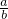 ≥
≥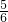 ;
;由Na元素可知:2n(Na2CO3)=n(NaNO2)+n(NaNO3),由N元素守恒可知n(NaNO2)+n(NaNO3)=n(NO2)+2n(N2O4)+n(NO)=
 +
+ +
+ =
= mol,所以2n(Na2CO3)=
mol,所以2n(Na2CO3)= mol,n(Na2CO3)=
mol,n(Na2CO3)=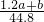 mol,该Na2CO3溶液的物质的量浓度为:
mol,该Na2CO3溶液的物质的量浓度为: =
=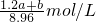 ;
;故答案为:
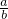 ≥
≥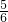 ;
;  ;
;(5)、设:2.016 L氮氧化物中含N2O4 x mol、NO2 y mol、NO z mol,
x+y+z=
 =0.09
=0.09 2x+y+3z=
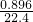 ×4 (得失电子守恒)
×4 (得失电子守恒) 2 x+y+z=0.05×2 (氮原子子守恒、钠离子守恒)
解得:x=0.01(mol),y=0.05(mol),z=0.03(mol)
∴V(N2O4):V(NO2)=n(N2O4):n(NO2)=0.01:0.05=1:5,
答:混和气体中N2O4与NO2的体积比为1:5,计算过程为:
设:2.016 L氮氧化物中含N2O4 x mol、NO2 y mol、NO z mol,x+y+z=
 =0.09
=0.09 2x+y+3z=
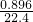 ×4 (得失电子守恒)
×4 (得失电子守恒) 2 x+y+z=0.05×2 (氮原子子守恒、钠离子守恒)
解得:x=0.01(mol),y=0.05(mol),z=0.03(mol)
∴V(N2O4):V(NO2)=n(N2O4):n(NO2)=0.01:0.05=1:5.
分析:(1)、NO必须和二氧化氮一起才能反应,根据反应分别求算出生成的NaNO2 和NaNO3,故NO2还剩余0.4mol单独与烧碱反应;(2)、由方程式2NO2+2NaOH=NaNO2+NaNO3+H2O和NO+NO2+2NaOH=2NaNO2+H2O可知,NO单独不能被吸收,NO和NO2混合气体被NaOH溶液被完全吸收,满足n(NO2):n(NO)≥1,当n(NO2):n(NO)=1时x值最小,计算x的最小值,因为混有NO,所以x最大值<2,据此确定x取值范围;
(3)、纯碱溶液处理氮氧化物废气,反应与上述类似,同时放出CO2,所以二氧化氮与碳酸钠反应生成NaNO2、NaNO3、CO2;
(4)、发生反应2NO2+Na2CO3=NaNO2+NaNO3+CO2,NO2+NO+Na2CO3=2NaNO2+CO2,从反应式就可以看出当n(NO2)/n(NO)≥1,把N2O4折换成NO2,计算a、b的关系;恰好反应溶液溶质为NaNO2、NaNO3,由N元素守恒可知n(NaNO2)+n(NaNO3)=n(NO2)+2n(N2O4)+n(NO),由Na元素可知2n(Na2CO3)=n(NaNO2)+n(NaNO3),计算n(Na2CO3)代入c=n/v,计算碳酸钠的浓度.
(5)、设2.016 L氮氧化物中含N2O4 x mol、NO2y mol、NO z mol,分别利用气体总物质的量、电子守恒、钠离子氮原子守恒列式求解.
点评:本题考查阅读理解信息的能力、混合反应的计算能力等,需要学生具备扎实的基础与利用信息、基础知识分析解决问题的能力,根据题给信息书写化学方程式,发现化学方程式中隐含的关系和规律是解题关键,难度稍大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目