题目内容
(1)SO2的转化率为______.如果向平衡混合气中充入N 2,SO2的转化率如何变化?______.
(2)若起始时加入amolSO2、b mol O2,且a:b=2:l,在同样温度和压强下,反应达到平衡时,测得混合气体的容积为210L.则 a=______,容器的起始容积为______SO3的体积分数为______
(3)若将密闭容器体积固定为200L,起始时加入xmolSO2、y mol O2和z mol SO3,反应达平衡时,温度、压强与(2)完全相同,容器内各气体的体积分数也与(2)达平衡时的情况完全相同,则x、y应该满足的关系式为______,x、z应该满足的关系式为______.
2SO3,利用三段式计算,
2SO2+O2
2SO3
起始:2mol 1mol 0
转化:2x x 2x
平衡:2-2x 1-x 2x
根据体积之比等于物质的量之比可知:(2-2x+1-x+2x):3=140:200,解之得x=0.9,所以SO2的转化率为
| 0.9×2 |
| 2 |
(2)起始时加入amolS02、b mol O2,且a:b=2:l,在同样温度和压强下,反应达到平衡时,与(1)平衡状态相同,为等效平衡,物质的转化率和百分含量都相同,设起始体积为V,则
| V |
| 200L |
| 210 |
| 140 |
| 2x |
| (2-2x+1-x+2x) |
| 1.8 |
| 3-0.9 |
| 6 |
| 7 |
故答案为:3; 300 L;85.7%(或
| 6 |
| 7 |
(3)若将密闭容器体积固定为200L,起始时加入xmolS02、y mol 02和z mol SO3,反应达平衡时,温度、压强与(2)完全相同,容器内各气体的体积分数也与(2)达平衡时的情况完全相同,为等效平衡,则有x=2y,且相当于只加二氧化硫和氧气时,起始时二氧化硫的物质的量(设为n)应为
| n |
| 2 |
| 200 |
| 140 |
| 20 |
| 7 |
| 20 |
| 7 |
故答案为:x=2y; x+z=
| 20 |
| 7 |

(14分)科学家一直致力于“人工固氮”的方法研究。
(1)目前合成氨的技术原理为:
该反应的能量变化如图所示。
①在反应体系中加入催化剂,反应速率增大,E2的变化是: 。(填“增大”、“减小”或“不变”)。
②将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:
5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率v(N2)= ,H2的转化率为 ,该反应在此温度下的化学平衡常数为 。(后两空保留小数点后一位)
③欲提高②容器中H2的转化率,下列措施可行的是 。
A.向容器中按原比例再充入原料气
B.向容器中再充入惰性气体
C.改变反应的催化剂
D.液化生成物分离出氨
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨。其实验装置如图所示。阴极的电极反应式为 。
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a 0。(填“大于”、“小于”或“等于”)
(14分)科学家一直致力于“人工固氮”的方法研究。
(1)目前合成氨的技术原理为: 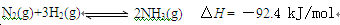
该反应的能量变化如图所示。
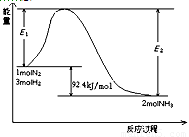
①在反应体系中加入催化剂,反应速率增大,E2的变化是: 。(填“增大”、“减小”或“不变”)。
②将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:
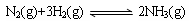
5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率v(N2)= ,H2的转化率为 ,该反应在此温度下的化学平衡常数为 。(后两空保留小数点后一位)
③欲提高②容器中H2的转化率,下列措施可行的是 。
A.向容器中按原比例再充入原料气
B.向容器中再充入惰性气体
C.改变反应的催化剂
D.液化生成物分离出氨
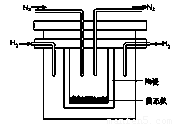
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨。其实验装置如图所示。阴极的电极反应式为 。
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:
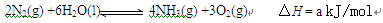
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
|
T/K |
303 |
313 |
323 |
|
NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
此合成反应的a 0。(填“大于”、“小于”或“等于”)
(14分)科学家一直致力于“人工固氮”的方法研究。
(1)目前合成氨的技术原理为: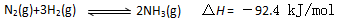
该反应的能量变化如图所示。
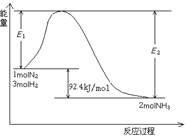
①在反应体系中加入催化剂,反应速率增大,E2的变化是: 。(填“增大”、“减小”或“不变”)。
②将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应: 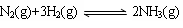
5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率v(N2)= ,H2的转化率为 ,该反应在此温度下的化学平衡常数为 。(后两空保留小数点后一位)
③欲提高②容器中H2的转化率,下列措施可行的是 。
A.向容器中按原比例再充入原料气
B.向容器中再充入惰性气体
C.改变反应的催化剂
D.液化生成物分离出氨
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨。其实验装置如图所示。阴极的电极反应式为 。
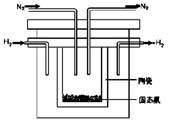
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:
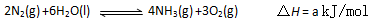
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
|
T/K |
303 |
313 |
323 |
|
NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
此合成反应的a 0。(填“大于”、“小于”或“等于”)