题目内容
已知N2O4(g) ![]() 2NO2 (g),在25℃的平衡常数
2NO2 (g),在25℃的平衡常数![]() = 0.14。判断总压为101.325 kPa时下列体系中反应的方向。
= 0.14。判断总压为101.325 kPa时下列体系中反应的方向。
(1)N2O4与NO2含量为13(物质的量之比)的气体混合物;
(2)N2O4与NO2含量等于41的气体混合物。
分析:只有在达到平衡时,平衡浓度之间的关系才具有平衡常数的数值,因此,对比QP和KP就可得知反应所处的热力学状态。
解:(1)该体系内N2O4与NO2的分压分别为![]() 和
和 ![]() 时,
时,
![]()
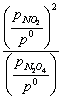 =
=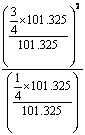 =2.25
=2.25
![]() >
>![]() ,反应逆向进行。
,反应逆向进行。
(2)当体系内N2O4与NO2的分压分别为![]() 和
和![]() 时,
时,![]()

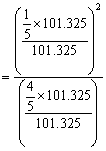 =0.05
=0.05
![]() <
<![]() ,反应正向进行。
,反应正向进行。

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案
相关题目
 2NO2 (g) ΔH<0,
2NO2 (g) ΔH<0,
 2NO2 (g) ΔH<0,
2NO2 (g) ΔH<0,
 N2O4 (g))
N2O4 (g))