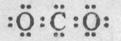题目内容
溴化碘(IBr)的化学性质很像卤素的单质,它能与大多数金属、非金属化合生成卤化物,它也能与水发生以下反应:IBr+H2O=HBr+HIO,下列有关IBr的叙述中,不正确的是( )。
| A.在很多反应中IBr是强氧化剂 |
| B.IBr与水反应时既作氧化剂,又作还原剂 |
| C.IBr与AgNO3溶液反应会生成AgBr沉淀 |
| D.IBr与NaOH溶液反应时,生成NaBr和NaIO |
B
此题是一道信息题,题中给出了三点信息:(1)溴化碘(IBr)暗示Br呈-1价,I呈+1价;(2)IBr性质与卤素相似;(3)IBr与水反应生成HIO和HBr。由(2)可知,IBr是一种强氧化剂。分析IBr中各元素的化合价,确定碘为+1价,溴为-1价。再结合(3),可知IBr与水的反应不是氧化还原反应,而是复分解反应。因此,A、C、D正确,B不正确。

练习册系列答案
相关题目
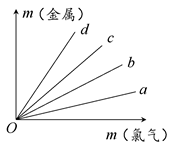
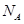 代表阿伏加德罗常数,下列说法不正确的是
代表阿伏加德罗常数,下列说法不正确的是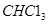 )中含有
)中含有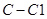 键的数目为1.5
键的数目为1.5 )所含的电子数为9
)所含的电子数为9