题目内容
自然界中存在一种尖晶石,化学式为MgAl2O4,已知该尖晶石中混有Fe2O3.现取一定量样品5.68g,恰好与100mL一定浓度的盐酸反应.该盐酸的浓度为
- A.2.2 mol?L-1
- B.3.3 mol?L-1
- C.3.0 mol?L-1
- D.1.8 mol?L-1
AC
分析:根据题意,尖晶石与盐酸反应,最终的产物是MgCl2、AlCl3、FelCl3.由于一定量样品5.68g,恰好与100mL一定浓度的盐酸反应,利用极值法进行讨论:当全部是MgAl2O4时,与盐酸反应最终生成MgCl2和AlCl3,1mol MgAl2O4消耗8molHCl,因为恰好溶解,根据n= 计算MgAl2O4的物质的量,进而计算消耗HCl的物质的量,根据c=
计算MgAl2O4的物质的量,进而计算消耗HCl的物质的量,根据c= 计算盐酸的浓度,
计算盐酸的浓度,
;假如全部是Fe2O3时,1molFe2O3消耗6molHCl,求出盐酸的物质的量浓度,实际盐酸的物质的量浓度应介于二者之间.
解答:假设全部是MgAl2O4时,5.68gMgAl2O4的物质的量为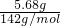 =0.04mol,与盐酸反应最终生成MgCl2和AlCl3,1mol MgAl2O4消耗8molHCl,故消耗HCl的物质的量为8mol×
=0.04mol,与盐酸反应最终生成MgCl2和AlCl3,1mol MgAl2O4消耗8molHCl,故消耗HCl的物质的量为8mol× =0.32mol,故盐酸的浓度为
=0.32mol,故盐酸的浓度为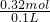 =3.2mol/L,
=3.2mol/L,
假如全部是Fe2O3时,5.68gFe2O3的物质的量为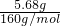 =0.0355mol,1molFe2O3消耗6molHCl,故消耗盐酸的物质的量为0.0355mol×6=0.213mol,故盐酸的物质的量浓度为
=0.0355mol,1molFe2O3消耗6molHCl,故消耗盐酸的物质的量为0.0355mol×6=0.213mol,故盐酸的物质的量浓度为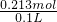 =2.13mol/L,
=2.13mol/L,
实际盐酸的物质的量浓度应介于二者之间,故选AC.
点评:本题考查混合物的有关计算,难度中等,利用混合物列方程进行计算,步骤繁琐而结果易错,导致费时而不易得分,注意利用极值法进行的计算.
分析:根据题意,尖晶石与盐酸反应,最终的产物是MgCl2、AlCl3、FelCl3.由于一定量样品5.68g,恰好与100mL一定浓度的盐酸反应,利用极值法进行讨论:当全部是MgAl2O4时,与盐酸反应最终生成MgCl2和AlCl3,1mol MgAl2O4消耗8molHCl,因为恰好溶解,根据n=
 计算MgAl2O4的物质的量,进而计算消耗HCl的物质的量,根据c=
计算MgAl2O4的物质的量,进而计算消耗HCl的物质的量,根据c= 计算盐酸的浓度,
计算盐酸的浓度,;假如全部是Fe2O3时,1molFe2O3消耗6molHCl,求出盐酸的物质的量浓度,实际盐酸的物质的量浓度应介于二者之间.
解答:假设全部是MgAl2O4时,5.68gMgAl2O4的物质的量为
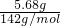 =0.04mol,与盐酸反应最终生成MgCl2和AlCl3,1mol MgAl2O4消耗8molHCl,故消耗HCl的物质的量为8mol×
=0.04mol,与盐酸反应最终生成MgCl2和AlCl3,1mol MgAl2O4消耗8molHCl,故消耗HCl的物质的量为8mol× =0.32mol,故盐酸的浓度为
=0.32mol,故盐酸的浓度为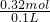 =3.2mol/L,
=3.2mol/L,假如全部是Fe2O3时,5.68gFe2O3的物质的量为
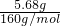 =0.0355mol,1molFe2O3消耗6molHCl,故消耗盐酸的物质的量为0.0355mol×6=0.213mol,故盐酸的物质的量浓度为
=0.0355mol,1molFe2O3消耗6molHCl,故消耗盐酸的物质的量为0.0355mol×6=0.213mol,故盐酸的物质的量浓度为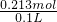 =2.13mol/L,
=2.13mol/L,实际盐酸的物质的量浓度应介于二者之间,故选AC.
点评:本题考查混合物的有关计算,难度中等,利用混合物列方程进行计算,步骤繁琐而结果易错,导致费时而不易得分,注意利用极值法进行的计算.

练习册系列答案
相关题目
自然界中存在一种尖晶石,化学式为MgAl2O4,已知该尖晶石中混有Fe2O3.现取一定量样品5.68g,恰好与100mL一定浓度的盐酸反应.该盐酸的浓度为( )
| A、2.2 mol?L-1 | B、3.3 mol?L-1 | C、3.0 mol?L-1 | D、1.8 mol?L-1 第Ⅱ卷(共84分) |