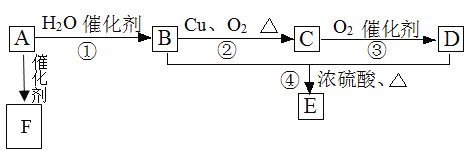
题目内容
【题目】将有机物完全燃烧,生成CO2和H2O。将6g该有机物的完全燃烧产物先通过浓硫酸,浓硫酸增重3.6g,再通过碱石灰,碱石灰增重8.8g。则该有机物的分子式为( )
A.C4H10B.C2H6OC.C3H8OD.C2H4O2
【答案】D
【解析】
浓硫酸增重3.6g,说明生成n(H2O)=![]() =0.2mol,碱石灰增重8.8g,说明生成n(CO2)=
=0.2mol,碱石灰增重8.8g,说明生成n(CO2)=![]() =0.2mol,根据元素守恒可知原有机物中n(H)=0.4mol,n(C)=0.2mol,则m(H)=0.4g,m(C)=2.4g,则原有机物中还含有m(O)=6g-0.4g-2.4g=3.2g,则n(O)=
=0.2mol,根据元素守恒可知原有机物中n(H)=0.4mol,n(C)=0.2mol,则m(H)=0.4g,m(C)=2.4g,则原有机物中还含有m(O)=6g-0.4g-2.4g=3.2g,则n(O)=![]() =0.2mol,所以该物质中n(H):n(C):n(O)=0.4:0.2:0.2=2:1:1,所以该物质的最简式为CH2O,题目所给选项中只有C2H4O2的最简式满足,故答案为D。
=0.2mol,所以该物质中n(H):n(C):n(O)=0.4:0.2:0.2=2:1:1,所以该物质的最简式为CH2O,题目所给选项中只有C2H4O2的最简式满足,故答案为D。

【题目】Ⅰ.测定化学反应速率
某同学利用如图装置测定化学反应速率。
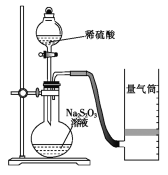
(已知:S2O32-+2H+=H2O+S↓+SO2↑)
(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是__;除如图所示的实验用品、仪器外,还需要的一件实验仪器是__。
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是___。
Ⅱ.为探讨化学反应速率的影响因素
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。已知:5H2C2O4+2KMnO4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
实验时,通过测定褪色所需时间来判断反应的快慢。限选试剂与仪器:0.20mol/LH2C2O4溶液,0.010mol/L酸性KMnO4溶液,蒸馏水,锥形瓶,恒温水浴槽,量筒,秒表。该小组设计了如下的方案。
物理量 | 水 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
体积/mL | 浓度/molL-1 | 体积/mL | 浓度/molL-1 | 体积/mL | ||
① | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
② | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 1.0 | 0.010 | 4.0 | 25 | ||
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:n(H2C2O4):n(KMnO4)≥__。
(2)实验③测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=__mol·L-1·min-1。
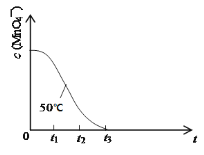
(3)请完成表格内二处空白__、__。
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。其中反应速率最快的阶段是__,原因是___。
【题目】某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹) 。

(1)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。①若在丙中加入适量水,即可制得氯水。将所得氯水进行实验,实验操作、现象、结论如下:
实验操作 | 现 象 | 结 论 |
氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气和水反应的产物具有酸性 |
实验的结论是否合理__________,(选填合理或不合理)请说明理由______________________。请利用上述装置设计一个简单的实验验证Cl-和S2-的还原性强弱,则甲、乙、丙中盛放的试剂是甲__________________ 乙__________________ 丙__________________
(2)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得并进行NO2有关实验。欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹________,再打开止水夹________,使烧杯中的水进入试管丁的操作是:___________________________________使试管中的气体逸出,NO2与水接触后即可引发烧杯中的水进入试管丁。
【题目】Ⅰ.下表是元素周期表的一部分, 回答下列问题:
a | ||||||||
b | c | d | e | |||||
f | g | h | i |
(1)d、e、f对应简单离子的半径由大到小的顺序为_______(用具体微粒符号表示)。
(2)元素i的单质溶于水,生成一种具有漂白作用的化合物,该化合物的电子式为_____;写出a与c形成的一种含18电子且既含极性键又含非极性键的化合物的分子式_________。
(3)以元素a的单质为燃料,以f的最高价氧化物对应的水化物为电解质溶液,请写出该燃料电池的负极反应方程式_________。
Ⅱ. (1)根据下列信息判断氢气燃烧生成水时的热量变化:
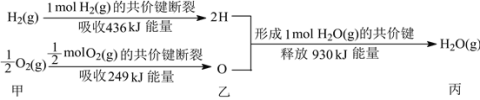
①H2(g)与O2(g)反应生成1molH2O(g)时放出的热量为________kJ;
②图中甲、乙、丙中物质所具有的总能量由大到小顺序为:________;
(2)铅蓄电池是最常见的二次电池,放电时的化学方程式为:Pb(s) + PbO2(s) + 2H2SO4(aq) = 2PbSO4(s) + 2H2O。负极反应式为__________,一段时间后,负极增重48克,转移电子_______mol。